



Содержание.
МЕДИЦИНСКАЯ РАДИОБИОЛОГИЯ
1.1. Немного истории
1.2. Некоторые понятия и термины
1.3. Прикладное значение радиобиологических исследований
ЛУЧЕВЫЕ ПОРАЖЕНИЯ
2.1. Молекулярный уровень воздействия
2.2. Клеточный уровень воздействия
2.3. Организменный уровень воздействия
2.4 Классификация последствий облучения
2.4.1. Соматическое детерминированные эффекты
2.4.2. Стохастические эффекты
УПРАВЛЕНИЕ РАДИОБИОЛОГИЧЕСКИМ ЭФФЕКТОМ
7.1 Радиопротекторы
7.2 Изменение эндогенного фона радиорезистентости
Знание закономерностей биологического действия ионизирующих излучений необходимо для обоснования медицинских мероприятий при радиационных поражениях и для регламентирования радиационных воздействий на человека, оказавшегося в сфере воздействия излучений при работе с их источниками, в неблагоприятной экологической обстановке и т.п. Природа ионизирующих излучений обусловливает множественность и разнообразие как самих первичных повреждений, так и их проявлений на различных уровнях организации живого. Значимость этих повреждений и проявлений неодинакова. Отсюда присущее радиобиологии стремление выделить каждый раз критические, ведущие события, определяющие конечный эффект.
Данная лекция посвящена некоторым аспектам медицинской радиологии: общей радиобиологии, радиобиологии клетки и организма. Будут рассмотрены физические основы биологического действия ионизирующего излучения, теория и механизмы радиобиологического эффекта, основные радиационные синдромы, противоопухолевая защита, отдаленные последствия облучения, научные основы лечебного применения ионизирующего излучения и принципы их гигиенического нормирования. На субклеточном уровне рассмотрены основные проявления и механизмы повреждений ядерной ДНК и внутриклеточных мембран, приводящие к повреждению генома и, как результат, к летальным и нелетальным поражениям клеток. На клеточном уровне представлены различные формы клеточной гибели и основные механизмы, вызывающие их развитие. Охарактеризованы основные признаки поражения систем клеточного обновления и показано их значение в развитии костномозговой и кишечной форм острой лучевой болезни, подчеркнута особая роль стволовых клеток в этих системах с точки зрения их восстановления. Продемонстрированы своеобразные проявления поражения центральной нервной системы после облучения в сверхсмертельных дозах. На основе представлений о значении в развитии лучевого поражения гибели клеток критических систем объяснены особенности поражения в зависимости от распределения поглощенных доз в пространстве и во времени. Приведены особенности, характеризующие стохастические и нестохастические эффекты облучения и показана их роль в возникновении патологических изменений после воздействия излучений в малых дозах. Дано современное объяснение феноменологии и механизмов проявления кислородного эффекта.
Парацельс в 1567 описал заболевание горняков («Шнеебергская легочная болезнь»), которое позднее было идентифицировано как рак легких. Заболевание шахтеров оказалось связанным с воздействием ионизирующих излучений радиоактивного газа радона и короткоживущих продуктов его распада, накапливающихся в воздухе плохо вентилируемых шахт. В конце 19-го века были открыто рентгеновское излучение (1895) и явление радиоактивности (1896). В последующем изучение свойств рентгеновых лучей и излучений радиоактивных элементов проводилось параллельно. В 1896 И.Р.Тарханов опубликовал полученные им в опытах на лягушках и насекомых данные, свидетельствующие об отчетливом действии ионизирующих излучений на центральную нервную систему и на развитие животных. Он писал: «… влияние лучей должно распространяться и на обмен веществ в сложных организмах, а отсюда и на ход всех функций». И.Р.Тарханов первый сформулировал идею рентгенотерапии: «Х-лучи могут служить не только для фотографирования и для диагноза, но и для воздействия на организм. И мы не удивимся, если в недалеком будущем лучами этими будут пользоваться с лечебной целью». Скоро лучевая терапия заняла ведущее положение среди методов лечения злокачественных новообразований. Одновременно появились сообщения о патогенных свойствах ионизирующих излучений: в 1896 – о дерматитах у лиц, подвергавшихся частому облучению, а в 1902 – о лучевом раке кожи. Так, в 1895 году помощник Рентгена В. Груббе получил радиационный ожог рук при работе с рентгеновскими лучами, а французский ученый А. Беккерель, открывший радиоактивность, получил сильный ожог кожи от излучения радия. В 1903 Е.С.Лондон обнаружил возникновение летальных исходов у мышей под влиянием воздействия на них ионизирующего излучения, а Г. Хейнеке обнаружил опустошение кроветворной ткани у животных, погибших в результате облучения. В 1907 было уже 7 случаев смерти от ионизирующей радиации.
Датой рождения радиационной генетики принято считать 1927 год, когда появилась публикация работы Германа Меллера, в которой показано, что рентгеновские лучи вызывают повышенную частоту появления мутантных потомков у дрозофил, родителей которых подвергали облучению. С тех пор ионизирующая радиация стала одним из основных инструментов исследования механизмов действия мутагенных факторов на клетки и целостные организмы, используя который, биологи пытались решить широкий круг проблем - от изучения воздействия излучений на растворы биополимеров до влияния радиации на эволюцию биосферы.
До 1945 исследования были направлены на разработку методов лучевой терапии, а также на выяснение характера вредного действия облучения на профессионалов и обоснование защитных мероприятий. В 1945 впервые применено ядерное оружие: при бомбардировке Хиросимы и Нагасаки погибло 200 тыс. человек. Массовый характер и особенности нового вида поражений человека обусловили необходимость изучения эффектов общего облучения в смертельных дозах и патологических процессов, возникающих в результате действия радиации. Разработка средств и методов диагностики, профилактики и лечения острой лучевой болезни и комбинированных радиационных поражений стали приоритетными практическими задачами радиобиологических исследований с конца сороковых годов. В процессе клинического наблюдения за пострадавшими при авариях ядерных энергетических установок и оказания им медицинской помощи изучены особенности течения различных форм лучевых поражений у человека, апробированы результаты экспериментальных разработок средств их лечения и разработаны принципы диагностических и лечебных мероприятий, в том числе и на случай возникновения массовых санитарных потерь. Авария на Чернобыльской АЭС показала, что и в мирных условиях возможны радиационные инциденты с тяжелыми последствиями: более двухсот человек, заболело острой лучевой болезнью, из которых тридцать семь погибло. Тогда же появился целый ряд крупномасштабных проблем, связанных с медицинским обеспечением ликвидации последствий аварии, с радиоактивным загрязнением больших территорий. Одновременно последствия Чернобыльского инцидента показали значимость проблем, связанных с воздействием сравнительно малых доз облучения. Недостаточно разработанными оказались вопросы совместного длительного воздействия внешнего и внутреннего облучения в малых дозах, комбинированного действия малых доз излучения и вредных токсикантов, сочетания с воздействием психологического стресса и др. Открытой оказалась проблема применения средств, способных снизить эффекты длительного воздействия радиации в малых дозах.
Ионизирующее воздействие фотонов (рентгеновское и гамма-излучение) на биологический материал опосредованно; сами по себе они не могут химически или биологически повредить клетку. Фотоны взаимодействуют с атомами или молекулами, например, с молекулами воды, что приводит к образованию высокоактивных короткоживущих свободных радикалов, которые проникают в критические структуры клетки, такие как ДНК и, возможно, мембраны, и разрушают химические связи.
Чувствительность разного биологических материалов к действию ионизирующего излучения существенно различно.
Радиочувствительность и радиорезистентность – понятия, характеризующие степень чувствительности животных и растительных организмов, а также их клеток и тканей к воздействию ионизирующих излучений. Чем больше возникает изменений в ткани под влиянием радиации, тем ткань более радиочувствительна, и, наоборот, способность организмов или отдельных тканей не давать патологических изменений при действии ионизирующих излучений характеризует степень их радиорезистентности, т.е. устойчивости к радиации.
В онкологии под радиочувствительностью (радиорезистентностью), понимают скорость и степень реакции опухоли в ходе лечения. Радиокурабельность отражает степень реализации предположения об уничтожении опухоли, с учетом ограничений, таких как устойчивость нормальной ткани. Эти два свойства не обязательно коррелируют: опухоль может быть высоко чувствительной, но радиоинкурабельной (лейкемия и миелома) или относительно радиорезистентной и радиокурабельной (т.е. плоскоклеточные ороговевающие карциномы головы, шеи и шейки матки). Примером опухоли, одновременно проявляющей свойства радиочувствительности и радиокурабельности, может служить лимфогранулематоз. Почечноклеточные карциномы и злокачественные меланомы являются радиорезистентными и радиоинкурабельными.
Различные организмы, а также различные органы и ткани всех растительных и животных организмов также обладают разной радиочувствительностью. Наибольшей радиочувствительностью у человека обладают половые клетки (сперматозоиды и яйцеклетки) и белые кровяные тельца (лейкоциты). Очень чувствительны к действию ионизирующей радиации костный мозг, селезенка и лимфатические узлы, т.е. органы кроветворения. Весьма чувствителен также эпителий желудочно-кишечного тракта. Изучение деятельности физиологических систем, в частности, нервной, показало высокую чувствительность центральной нервной системы к действию даже малых доз радиации на организм. Костная и мышечная ткани являются наименее чувствительными к действию ионизирующей радиации, т.е. они наиболее радиорезистентны.
Клеточная радиочувствительность - интегральная характеристика клетки, определяющая вероятность ее гибели после радиационного воздействия. Синонимом радиочувствительности является радиопоражаемость. Термин радиочувствительность применяется также и по отношению к тканям, органам, организму в целом, биологическим видам и др. При равной радиочувствительности биологических объектов степень их поражения определяется, прежде всего, дозой излучения. (Информация, касающаяся дозовых проблем, собрана в следующей лекции)
Уже в период ранних радиобиологических наблюдений, имевших преимущественно описательный характер, стало очевидно, что повреждающее действие ионизирующих излучений на биообъекты носит дозозависимый характер. Построение графиков типа «доза-эффект» позволило сравнивать радиочувствительность биообъектов, сопоставляя дозы излучения, вызывающие в них равные по величине эффекты, а также оценить способности некоторых веществ («радиомодификаторов») изменять радиочувствительность биологических объектов. В качестве основного показателя радиомодифицирующей эффективности вещества используют отношение доз излучения, вызывающих один и тот же эффект в биообъекте в присутствии и в отсутствии радиомодификатора. Такой показатель получил название фактора изменения дозы (сокращенно – ФИД).
| Например: ФИД = | СД50 с радиопротектором |
| СД50 без радиопротектора |
Радиочувствительность клеток зависит от их физиологического состояния; при усилении функциональной активности повышается радиочувствительность. Быстро размножающиеся клетки млекопитающих проходят четыре стадии цикла: митоз, 1 промежуточный период (GI), синтез ДНК и II промежуточный период (G2). Наиболее чувствительны к облучению клетки в фазах митоза и G2 (которая непосредственно предшествует митозу). У клеток, находящихся в начальной стадии усиленного деления, радиочувствительность резко возрастает. На этом основан принцип лучевого лечения злокачественных опухолей. Незрелые формы клеточных элементов (зародышевые и молодые ткани, а также органы в период их формирования) более чувствительны к действию радиации. Максимальная резистентность к радиации наблюдается в период синтеза ДНК. Среди зрелых форм клеточных элементов радиочувствительность тем меньше, чем больше срок жизни клеточного элемента (т.е. чем он старее).
Важными определяющими факторами острой или поздней реакции тканей являются кинетические характеристики дифференциации и пролиферации, некоторые ткани могут демонстрировать оба типа токсичности. Острая реакция развивается в ходе лечения или спустя несколько недель. К остро-реагирующим тканям относятся: кожа (десквамация), слизистая оболочка кишечника, тромбоциты и лейкоциты. Развитие поздней реакции наблюдается в период от нескольких месяцев до года, такая реакция свойственна костям, костному и спинному мозгу, таким внутренним органам, как легкие, печень, почки, молочная железа и половые железы. В коже возникает фиброз.
Для прогнозирования реакции опухоли на облучение разработаны специальные клинико-лабораторные критерии. Например, клинико-иммунологические критерии применяются для прогнозирования реакции опухоли на облучение у больных раком молочной железы.
Закономерности биологического действия ионизирующих излучений используются для обоснования мероприятий по обеспечению радиационной безопасности и разработки средств медицинской защиты при лучевых поражениях. Радиобиологические данные - основа для регламентации радиационных воздействий при использовании источников ионизирующих излучений в науке, в медицине, технике, сельском хозяйстве и т.п. Эти аспекты входят в компетенцию смежной научной дисциплины – радиационной гигиены.
В послевоенный период были апробированы тысячи препаратов в поисках эффективных модификаторов лучевого поражения. Некоторые из них ослабляли поражение при однократном введении в организм до облучения, но были неэффективны в пострадиационный период. Такие препараты получили общее название радиопротекторов. Относясь к веществам разных химических классов и обладая различными механизмами противолучевого действия, они имеют сходство в характере влияния на клеточный метаболизм: введенные в радиозащитных дозах, эти препараты всегда отклоняют его параметры за пределы физиологической нормы. «Биохимический шок», обусловливает сравнительно высокую токсичность радиопротекторов при введении в радиозащитных дозах, особенно при многократном введении. В случаях внезапности или продолжительности возможного облучения, когда радиозащитные средства необходимо вводить многократно и длительно, радиопротекторы не применимы. В ходе поиска менее токсичных препаратов, пригодных для систематического приема, были получены препараты, дающие небольшой, но зато не сопряженный с неблагоприятным побочным действием радиозащитный эффект. Такие противолучевые средства выделены в самостоятельную группу средств повышения радиорезистентности организма. Препараты, влияющие на развитие начальных этапов лучевого поражения и тем самым ослабляющие его тяжесть при введении в ранние сроки после облучения, называются: «средства ранней патогенетической терапии лучевых поражений». В отдельную группу выделяют средства борьбы с проявлениями первичной реакции на облучение.
Изучение механизмов действия ионизирующих излучений позволило обосновать принципы применения средств терапии в период разгара лучевых поражений. В профилактике и лечении лучевых поражений большое значение имеют также средства дезактивации, предназначенные для удаления радиоактивных веществ из объектов внешней среды и с поверхности тела, и средства профилактики внутреннего облучения - препараты, препятствующие инкорпорации радионуклидов и способствующие выведению их из организма. Способность ионизирующих излучений вызывать повреждение и гибель клеток представляют практический интерес и как основа лучевой терапии при злокачественных новообразованиях, получающей все большее распространение. Раскрытие радиобиологических закономерностей необходимы для использования новых видов излучений, выбора рациональных режимов облучения, применения радиосенсибилизирующих средств, сочетания с другими способами воздействия на опухоль (химиотерапия, гипертермия). Здесь тоже снижение степени повреждения здоровых тканей оказывается существенным аспектом оптимизации лучевой терапии.
Для радиобиологических исследований характерен подход, заключающийся в последовательном изучении процессов на всех уровнях биологической организации от молекулярного до организменного, строгом количественном анализе полученных материалов. Исследователь имеет возможность воздействовать излучением как на всю глубину биологического объекта, так и строго локально. Все это определяет высокую надежность и информативность сведений, получаемых радиобиологическими методами. Благодаря этим особенностям именно радиобиологические данные позволили раскрыть возможности ферментативной репарации повреждений ДНК, обнаружить и уточнить содержание кооперативных межклеточных взаимодействий в иммунных реакциях, установить основные закономерности дифференцировки клеток крови, решить важнейшие проблемы молекулярной биологии, мутагенеза, онкогенеза, геронтологии и т.п.
Таким образом, можно назвать следующие три основные области применения радиобиологии :
защита от вредных эффектов облучения;
совершенствование методов лучевой терапии;
диобиологические методы как инструмент познания общебиологических закономерностей.
Радиация по самой своей природе вредна для жизни. Малые дозы облучения могут “запустить” не до конца еще изученную цепь событий, приводящих к раку или генетическим повреждениям. При больших дозах радиация может разрушать клетки, повреждать ткани органов и явиться причиной скорой гибели организма. Повреждения, вызываемые большими дозами облучения, обыкновенно проявляются в течение нескольких часов или дней. Раковые заболевания, однако, проявляются спустя много лет после облучения, — как правило, не ранее чем через одно-два десятилетия. А врожденные пороки развития и другие наследственные болезни, вызываемые повреждением генетического аппарата, по определению проявляются лишь в следующем или последующих поколениях: это дети, внуки и более отдаленные потомки индивидуума, подвергшегося облучению.
Рис.1. Воздействие ионизирующего излучения на ткани организма
 |
Заряженные частицы. Проникающие в ткани организма альфа- и бета-частицы теряют энергию вследствие электрических взаимодействий с электронами тех атомов, близ которых они проходят (Гамма-излучение и рентгеновские лучи передают свою энергию веществу несколькими способами, которые в конечном счете также приводят к электрическим взаимодействиям. |
 |
Электрические взаимодействия. За время порядка десяти триллионных секунды после того, как проникающее излучение достигнет соответствующего атома в ткани организма, от этого атома отрывается электрон. Последний заряжен отрицательно, поэтому остальная часть исходного нейтрального атома становится положительно заряженной. Этот процесс называется ионизацией. Оторвавшийся электрон может далее ионизировать другие атомы. |
 |
Физико-химические изменения. И свободный электрон, и ионизированный атом обычно не могут долго пребывать в таком состоянии и в течение следующих десяти миллиардных долей секунды участвуют в сложной цепи реакций, в результате которых образуются новые молекулы, включая и такие чрезвычайно реакционноспособные, как "свободные радикалы". |
 |
Химические изменения. В течение следующих миллионных долей секунды образовавшиеся свободные радикалы реагируют как друг с другом, так и с другими молекулами и через цепочку реакций, еще не изученных до конца, могут вызвать химическую модификацию важных в биологическом отношении молекул, необходимых для нормального функционирования клетки. |
 |
Биологические эффекты. Биохимические изменения могут произойти как через несколько секунд, так и через десятилетия после облучения и явиться причиной немедленной гибели клеток, или такие изменения в них могут привести к раку. |
В зависимости от вида излучений, дозы облучения и его условий возможны различные виды лучевого поражения. Это острая лучевая болезнь (ОЛБ) - от внешнего облучения, ОЛБ - от внутреннего облучения, хроническая лучевая болезнь, различные клинические формы с преимущественно локальным поражением отдельных органов, которые могут характеризоваться острым, подострым или хроническим течением; это отдаленные последствия, среди которых наиболее существенно возникновение злокачественных опухолей; дегенеративные и дистрофические процессы (катаракта, стерильность, cклеротические изменения). Сюда же относят генетические последствия, наблюдаемые у потомков облученных родителей. Вызывающие их развитие ионизирующие излучения, благодаря высокой проникающей способности воздействуют на ткани, клетки, внутриклеточные структуры, молекулы и атомы в любой точке организма.
Живые существа на воздействие излучений реагируют различно, причем развитие лучевых реакций во многом зависит от дозы излучений. Поэтому целесообразно различать: 1) воздействие малых доз, примерно до 10 рад; 2) воздействие средних доз, обычно применяемых с терапевтическими целями, которые граничат своим верхним пределом с воздействием высоких доз. При воздействии излучении различают реакции, возникающие немедленно, ранние реакции, а также поздние (отдаленные) проявления. Конечный результат облучения часто во многом зависит от мощности дозы, различных условий облучения и особенно от природы излучений. Это относится также к области применения излучений в клинической практике с лечебными целями.
Радиация по-разному действует на людей в зависимости от пола и возраста, состояния организма, его иммунной системы и т. п., но особенно сильно - на младенцев, детей и подростков.
Табл.1. Радиационные эффекты облучения человека.
|
Радиационные эффекты облучения человека |
|
| Соматические эффекты | Генетические эффекты |
| Лучевая болезнь | Генные мутации |
| Локальные лучевые поражения | Хромосомные аберрации |
| Лейкозы | |
| Опухоли разных органов | |
Биологическое действие ионизирующих излучений (альфа- и бета- частицы, гамма- кванты, протоны и нейтроны) в живом организме условно можно подразделить на три уровня - молекулярный, клеточный и организменный (системный).
При облучении водных растворов даже чистых химических веществ могут наблюдаться чрезвычайно сложные процессы. Тем более это относится к таким сложным молекулам, как белки или нуклеиновые кислоты, которые в результате облучения подвергаются различным химическим или физико-химическим изменениям.
При физическом взаимодействии ионизирующего излучения с живыми тканями в процессе превращения этого излучения в химическую энергию в организме зарождаются активные центры радиационно-химических реакций. Основным непосредственным результатом поглощения энергии излучения любым веществом, в частности биообъектом, является ионизация и возбуждение его атомов и молекул. При этом образуются «горячие» (высокоэнергетичные) и исключительно реакционные частицы – осколки молекул: ионы и свободные радикалы. В дальнейшем происходит миграция поглощенной энергии по макромолекулярным структурам и между отдельными молекулами, разрывы химических связей, образование свободных радикалов и реакции между ними и другими, как уже поврежденными, так и исходными молекулами. При этом возникают молекулы нового, часто чужеродного для организма состава. Эти эффекты могут быть следствием поглощения энергии излучения самими макромолекулами белков, нуклеопротеидов, структурами внутриклеточных мембран. В этом случае говорят о прямом действии излучения.
Поскольку у человека основную часть массы тела составляет вода (порядка 75%), первичные процессы во многом определяются поглощением излучения водой клеток, ионизацией молекул воды с образованием высокоактивных в химическом отношении радикалов типа ОН- и Н+ . В присутствии кислорода образуется также свободный радикал гидроперекиси (H2O-) и перекись водорода (H2O2), являющиеся сильными окислителями.
 При радиолизе воды происходит сдвиг кислотно-щелочного баланса, изменения в окислительно-восстановительных процессах, приводящие к нарушению обмена веществ в организме. Продукты радиолиза активно вступают в реакцию с белковыми молекулами, часто образуя токсичные соединения. Образовавшиеся исключительно вредные для организма и реакционноспособные перекисные соединения, запускают целую цепь последовательных биохимических реакций и постепенно приводят к разрушению клеточных мембран (стенок клеток и других структур). Это приводит к нарушениям жизнедеятельности отдельных функций или систем организма в целом.
При радиолизе воды происходит сдвиг кислотно-щелочного баланса, изменения в окислительно-восстановительных процессах, приводящие к нарушению обмена веществ в организме. Продукты радиолиза активно вступают в реакцию с белковыми молекулами, часто образуя токсичные соединения. Образовавшиеся исключительно вредные для организма и реакционноспособные перекисные соединения, запускают целую цепь последовательных биохимических реакций и постепенно приводят к разрушению клеточных мембран (стенок клеток и других структур). Это приводит к нарушениям жизнедеятельности отдельных функций или систем организма в целом.
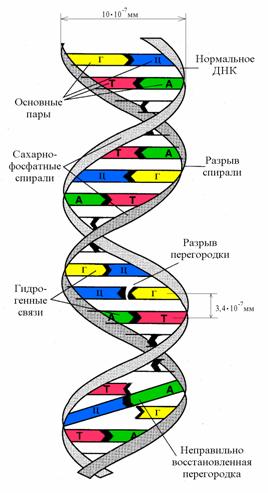
Рис.2. Влияние радиоактивного облучения на молекулу ДНК
Повреждение биомолекул химически активными продуктами радиолиза воды называют непрямым (косвенным) действием излучения.
В зависимости от величины поглощенной дозы и индивидуальных особенностей организма, вызванные изменения могут быть обратимыми или необратимыми.
Прямое действие ионизирующего облучения может вызвать непосредственно гибель или повреждение (обратимое или необратимое) клеток организма. В дальнейшем под действием физиологических процессов в клетках возникают функциональные изменения, подчиняющиеся уже биологическим законам жизни и гибели клеток, и отклонения в жизнедеятельности организма.
Из многих начальных молекулярных повреждений наибольшее значение придают повреждениям уникальных структур ядерной ДНК, а также внутриклеточных мембран. Перечисленные процессы осуществляются в три последовательно протекающие стадии: физическую, физико-химическую и химическую в течение чрезвычайно короткого промежутка времени (в пределах 1 миллисекунды) и являются общими для действия излучений как на живую, так и на неживую материи. Последующая биологическая стадия - вторичные, (радиобиологические), эффекты на всех уровнях организации живого, занимает значительно большее время, продолжается иногда в течение всей жизни (Табл.2).
Молекулы дезоксирибонуклеиновой кислоты (ДНК), представляющие главную составную часть наследственного вещества высших организмов, имеют нитевидную форму в виде двойных спиралей. При облучении нити ДНК резко скручиваются, образуются водородные мостики между различными нитями ДНК, нарушается спиральное строение молекулы; особенно характерно разрушение двойных спиралей ДНК, скручивание или внутримолекулярная полимеризация (образование молекулярных сеток), раскрытие двойных спиралей, разветвление и т. п. Молекулярный вес, так же как и радиус спиралей ДНК, изменяется в зависимости от величины дозы облучения, а также в зависимости от мощности дозы излучения.
Табл. 2. Основные стадии в действии излучений на биологические системы
| Стадия | Процессы | Продолжительность стадии |
| Физическая | Поглощение энергии излучения; образование ионизированных и возбужденных атомов и молекул | 10–16 - 10-15 с |
| Физико- химическая | Перераспределение поглощенной энергии внутри молекул и между ними, образование свободных радикалов | 10-14 - 10-11 с |
| Химическая | Реакции между свободными радикалами и между ними и исходными молекулами. Образование широкого спектра молекул с измененными структурой и функциональными свойствами. | 10-6 - 10-3 с |
| Биологическая | Последовательное развитие поражения на всех уровнях биологической организации от субклеточного до организменного; развитие процессов биологического усиления и процессов восстановления. | Секунды - годы |
Клеточный уровень воздействия включает в себя все нарушения и процессы, обусловленные изменениями функциональных свойств облученных клеточных структур. Наиболее опасными повреждениями клетки являются повреждения механизма митоза и хромосомного аппарата Количество клеток с такими повреждениями в облученной популяции находится в прямой зависимости от дозы облучения, блокирования процессов физиологической регенерации, жизнестойкости организма. Изменения на клеточном уровне приводят к нарушению наследственных структур, угнетению кроветворения, подавлению сперматогенеза, угнетению кроветворения т.е., в конечном счете, влияют на весь механизм жизнедеятельности организма многоклеточных и высших животных.
Повреждения внутриклеточных структур приводят к изменению, извращению метаболических процессов в клетках, следствием чего является появление новых нарушений уже после окончания воздействия радиации. Например, нарушения строения нуклеотидов и их последовательностей в ДНК и РНК ведут к дефициту необходимых для нормальной жизнедеятельности продуктов матричного синтеза, а также к наработке несвойственных клетке, чужих для нее продуктов. Нарушение структуры ферментов приводит к замедлению ферментативных реакций, накоплению аномальных метаболитов, часть которых имеют свойства радиотоксинов. Такой ход событий назван «биологическим усилением». В результате совокупности этих процессов могут возникнуть серьезные нарушения жизнедеятельности, и даже гибель клетки. С другой стороны, возникшие повреждения могут быть залечены с восстановлением в итоге нормальной жизнедеятельности клетки. Чем выше доза облучения, тем больше возникает первичных повреждений, и тем меньше возможность их полного восстановления. Повреждение и гибель клеток лежат в основе развития поражения тканей, органов и организма в целом при всех видах радиационных воздействий.
Метаболизм – 1) то же, что обмен веществ. 2) В более узком смысле – промежуточный обмен, т.е. превращение определенных веществ внутри клеток с момента их поступления до образования конечных продуктов.
Функции обмена веществ в живом организме являются результатом многих взаимосвязанных реакций. Во многих случаях вещества, участвующие в реакциях, настолько изменяются, что можно говорить об образовании нового вещества, которое находится в организме в состоянии подвижного равновесия. В результате прямого и косвенного воздействия излучений не только изменяются сами молекулы живого вещества, но в значительной степени меняется также скорость реакций, протекающих с участием ферментов, и наряду с этим нарушается и подвижное равновесие. Указанные явления наблюдаются в живых клетках и тканях.
Функции обмена веществ у клеток всей популяции, которые полностью стали стерильными, вначале могут быть в значительной степени сохранены. Такие клетки во многих отношениях еще не отличаются от необлученных. Лишь при очень высоких дозах облучения, порядка 105 —106 рад, в результате внезапно наступающих тяжелых нарушений обмена наступает быстрая гибель как одноклеточных организмов, так и клеток высших организмов.
Некоторые радиационно-биохимические изменения появляются уже после воздействия относительно малых доз, другие изменения наступают лишь в результате воздействия средних или высоких доз излучений. Среди нарушений обмена веществ, возникающих при воздействии ионизирующих излучений, на первое место следует поставить нарушение самого радиочувствительного субстрата - нуклеиновых кислот. Лучевые поражения в виде угнетения синтеза нуклеиновых кислот нельзя рассматривать как непосредственную причину угнетения клеточного деления или разрыва хромосом, которые могут привести к их грубым морфологическим нарушениям, определяемым при митозах после облучения. Нарушения других видов обмена, например углеводного, говорят об его очень низкой радио чувствительности. Изменения углеводного обмена после облучения, в частности угнетение анаэробного гликолиза, становятся заметными лишь после воздействия в дозах порядка 5000 -20000 р.; нарушение клеточного дыхания обычно наблюдается в результате воздействия еще больших доз—от 20000 до 100000 р.
В клеточных популяциях с митотическим делением клеток после облучения сначала отмечается кратковременное увеличение частоты митозов, а затем падение до определенной минимальной величины. Подобное явление назвали «первичным эффектом излучений». Вслед за этим число делящихся клеток снова увеличивается при условии, что величина дозы излучений была не очень велика и не все клетки потеряли способность к размножению. Минимальное число митозов и время их появления зависят от величины дозы излучений. В случае облучения, раковых клеток, когда применяются обычные для лучевой терапии дозы, минимальное число митозов большей частью наблюдается через несколько часов. Затем следует медленное повышение их числа, что определяется как «вторичный эффект излучений».
Для первичного и вторичного эффекта излучений характерны определенные типы хромосомных изменений. При первичном эффекте в клетках, еще сохраняющих митотическую активность, обнаруживаются преимущественно следующие типы хромосомных изменений: пикноз ядра, псевдоамитозы и склеивание хромосом, а также агглютинация хроматина. В противоположность этому при вторичном эффекте наблюдаются структурные изменения хромосом. Хромосомные аберрации вторичного эффекта морфологически проявляются в клетках преимущественно в виде образования фрагментов и хромосомных мостиков.
Механизм хромосомных изменений при первичном и вторичном эффекте различен. Хромосомные изменения, типичные для первичного эффекта, возникают главным образом в тех клетках, которые во время облучения имели митотическую активность и находились в стадии метафаза. У определенного числа этих клеток наблюдаются митозы, частота которых снижается в результате облучения. У других митотически делящихся клеток, достигших или прошедших стадию метафазы, митозы продолжаются, но в более замедленном темпе.
Среди молекулярных повреждений особое место занимает радиационное поражение ДНК, которую часто называют основной мишенью при действии радиации на клетки. Структуры ДНК уникальны. Если повреждения молекул других типов могут быть скомпенсированы за счет оставшихся неповрежденными молекул белков, полисахаридов и т.п., то в случае ДНК такой путь исключен. Однако, если дело идет о ДНК в неделящихся клетках, повреждение каких-то участков ее цепи может и не сказаться существенно на жизнедеятельности этих клеток. Для делящихся клеток значение повреждения ДНК трудно переоценить. Если в результате облучения возникли называвшиеся ранее повреждения ДНК, например, двойные разрывы или сшивки, нормальная репликация осуществиться не может. При формировании хромосом повреждения ДНК проявляются возникновением мостов, фрагментов и других типов хромосомных аберраций, многие из которых летальны, поскольку при них невозможно равномерное распределение генетического материала между дочерними клетками. Эта форма гибели клеток в митозе получила наименование репродуктивной гибели.
Митоз – способ деления клеток, обеспечивающий тождественное распределение генетического материала между дочерними клетками и преемственность хромосом в ряду клеточных поколений. Обычно подразделяется на несколько стадий: профаза, прометафаза, метафаза, анафаза, телофаза. Часто митозом называется процесс деления не только ядра, но и всей клетки, т.е. включают в него цитотомию.
Количество повреждений ДНК, возникающих в результате облучения, достаточно велико. Так, например, при облучении в дозе 1 Гр в каждой клетке человека возникает около тысячи одиночных и ста-двухсот двойных разрывов. Каждое из этих событий могло бы иметь фатальные последствия, если бы не существовало системы, способной ликвидировать большинство возникших повреждений ДНК. Существование в клетках механизмов и ферментных систем, обеспечивающих восстановление большинства начальных повреждений ДНК, обусловлено необходимостью поддержания стабильности генома, восстановления от постоянно возникающих повреждений ДНК в результате воздействия радиационного фона, присутствия в среде химических мутагенов, нарушений и сбоев, случайно возникающих в процессе жизнедеятельности клеток. Без таких механизмов организм не достигнет взрослого состояния, не оказавшись жертвой злокачественного образования или каких-то других последствий повреждения генетического материала. Непосредственной причиной репродуктивной гибели клеток являются невосстанавливаемые повреждения ДНК, прежде всего, двойные разрывы цепей и повреждения ДНК-мембранного комплекса.
Еще одним важным для организма результатом лучевого повреждения ДНК является возникновение наследуемых повреждений генетического материала - мутаций, следствием которых может быть злокачественное перерождение соматических клеток (клетки тела) или дефекты развития у потомства. Вызванная облучением дестабилизация ДНК, процесс репарации ее повреждений могут способствовать внедрению в геном клетки или активации онковирусов, ранее существовавших в геноме в репрессивном состоянии. При воздействии малых доз облучения эти процессы являются одним из наиболее существенных проявлений повреждающего действия радиации.
Репарация свойственный клеткам всех организмов процесс восстановления природной структуры ДНК, поврежденной при нормальном биосинтезе ее в клетке или под воздействием различных физических или химических агентов. Осуществляется специальными ферментными системами клетки.
Другая мишень действия радиации на клетки - внутриклеточные мембраны. Активация под влиянием облучения реакций свободнорадикального перекисного окисления липидов может привести к деструктивным изменениям мембран, к поражению мембраносвязанных ферментов, к нарушениям проницаемости мембран, нарушениям активного транспорта веществ через мембраны, снижению ионных градиентов в клетке, нарушениям процесса синтеза АТФ, к выходу ферментов из мест их специфической локализации, поступлению их в ядро и как следствие этого к дезорганизации ядерных структур и гибели клетки. Такой тип гибели клеток называется интерфазной гибелью. По этому типу могут погибать как неделящиеся, так и делящиеся клетки. Другой причиной интерфазной гибели клеток после облучения является активация процессов апоптоза, в ходе которого происходит межнуклеосомная деградация хроматина, проявляющаяся позднее фрагментацией ядра. Радиационно – индуцированный апоптоз часто рассматривается как результат включения программы клеточной гибели. Процессы апоптоза наблюдаются в большинстве погибающих после облучения лимфоидных клеток. Продукты активирующегося под влиянием облучения перекисного окисления липидов являются «радиотоксинами», способными сами по себе оказывать эффекты, сходные с облучением. Их возникновение играет важную роль в механизмах развития лучевого поражения при с их образованием дистанционные эффекты облучения.
В результате облучения могут наблюдаться следующие основные виды клеточных реакций: угнетение деления, разные типы хромосомных аберраций и различные летальные эффекты. Угнетение клеточного деления относится к функциональным неспецифическим клеточным нарушениям, носит временный, обратимый характер и может наблюдаться как у одноклеточных организмов, так и у клеток, составляющих ткани высших организмов. Как правило, угнетение клеточного деления является результатом воздействия малых доз излучения. При воздействии больших доз клеточное деление полностью прекращается и приводит к бесплодию. При воздействии разных видов излучений длительность обратимого угнетения клеточного деления и процент клеток, у которых деление полностью прекратилось, возрастают по мере увеличения дозы излучения. С увеличением дозы излучений все большее число клеток теряет способность к размножению или у них временно прекращается процесс деления. Одним из показателей нарушения этой способности клеток к размножению как у одноклеточных, так и у клеток тканей высших организмов является возникновение гигантских форм клеток.
Итак, в основе патогенного действия излучений на многоклеточные организмы, включая человека, лежит непосредственное лучевое поражение клеток. Наиболее существенным является повреждение ядерного хроматина, которое часто приводит к гибели клетки (летальный эффект), либо к возникновению в ней передающейся по наследству мутации. Результатом последней может явиться, например, злокачественное перерождение клетки и развитие через несколько лет новообразования (генетический эффект).
Организменный (системный) уровень является результатом биологического воздействия ионизирующего излучения на клетки и органы живого организма, так как деятельность всех их находится в постоянной взаимосвязи и взаимозависимости. Под действием энергии радиоактивных частиц или электромагнитных колебаний может происходить образование раневой поверхности или разрыв хромосом. В абсолютном большинстве случаев при этом клетки погибают, но в очень редких случаях, при наличии особых биохимических условий, клетки с поврежденными хромосомами делятся и дают начало новой ткани, не свойственной облученному органу (опухоли).
При этом вероятность развития опухоли тем больше, чем больше доза облучения на клетку и чем больше клеток подвергалось облучению одинаковой дозой. В результате гибели клеток при прямом действии ткань не справляется со своими функциональными нагрузками и наступает декомпенсация ее функции с клиническими нарушениями, свойственными потери функции облученного органа при других заболеваниях. Следует иметь ввиду, что все ткани обладают регенеративной способностью, т.е. способностью к восстановлению клеток на пораженном участке. Скорость регенерации клеток у различных тканей различна. На действие радиации ткани реагируют так же как на любой другой раздражитель: механический, термический, химический и др.
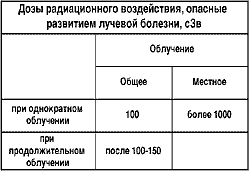
После разрушения клеток ткань начинает ускоренно делить здоровые клетки, восполняя утерянные. Однако регенерирующим способностям тканей есть предел. Пока доза облучения разрушает клетки в пределах регенеративных способностей ткани, мы еще не замечаем действие радиации, но как только доза вызывает разрушение клеток в количестве, превышающем регенеративные способности ткани, ткань не справляется со своими функциями и начинает проявляться функциональные расстройства - это порог дозы, после которого появляются детерминированные эффекты. Тяжесть этих эффектов прямо зависит от дозы облучения. Эти эффекты проявляются у всех облученных после превышения порога дозы, и для каждого эффекта существует своя пороговая доза. Так, после разового облучения дозой свыше 0,15 Зв у облученных появляется помутнение хрусталика, при дозе облучения свыше 0,2 Зв - стерильность яичников, при дозе более 0,4 Зв - угнетение функции костного мозга.
При указанных дозах эти явления могут быть непродолжительными, а при больших дозах они могут носить стойкий характер. При облучении в дозе более 1 Зв развивается лучевая болезнь легкой степени, при дозе 2 Зв - средней тяжести, при дозе свыше 3 Зв - тяжелая форма, при дозе более 4 Зв - крайне тяжелая форма, а доза разового облучения на все тело 6 Зв считается абсолютно смертельной. Все эти детерминированные эффекты, к ним можно отнести еще и лучевые ожоги. Тяжесть заболевания зависит от облученного органа. Наиболее тяжело проявляются последствия облучения всего тела по сравнению с облучением отдельных частей тела или органов. Поэтому различают облучение местное и общее. Указанные эффекты, как уже говорилось, проявляются после определенного порога дозы, и эта концепция биологического действия называется пороговой. Исходя из наличия предела регенеративных способностей тканей, существует зависимость биологического эффекта действия радиации от времени, за которое получена одна и та же доза облучения. Чем меньше время, за которое получена доза, тем больше отрицательный эффект и тяжелее лучевое поражение. Например доза в 2,50 Зв за сутки приведет к развитию острой лучевой болезни средней тяжести, а равномерно растянутая на 50 лет не вызовет никаких изменений, обнаруживаемых современными методами медицинских исследований. Это положено в основу гигиенического нормирования.
Суммарное воздействие этих соматических нарушений в деятельности органов и тканей вызывает возникновение очагов повышенной возбудимости в коре головного мозга, что приводит к дискорреляции между нервной системой и железами внутренней секреции и другими системами организма.
Классификацию возможных последствий облучения можно представить схемой Табл.3.
Табл.3. Классификация последствий облучения.
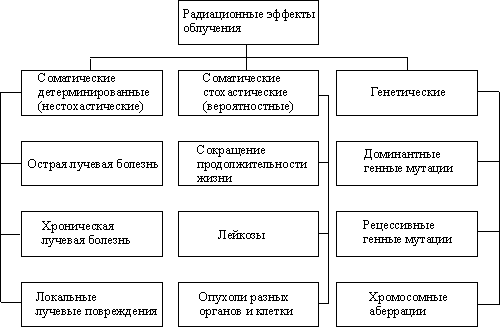
Соматические (телесные) эффекты - это последствия воздействия облучения на самого облученного, а не на его потомство. Соматические эффекты делят на стохастические (вероятностные) и нестохастические (детерминированные). К нестохастическим соматическим эффектам относят поражение, вероятность возникновения которых и степень тяжести поражения прямо зависит от дозы облучения и для возникновения которых существует дозовый порог. Стохастическими эффектами считаются такие, для которых от дозы зависит только вероятность возникновения, а не их тяжесть, и отсутствует дозовый порог.
Пороговые (детерминированные) эффекты возникают когда число клеток, погибших в результате облучения, потерявших способность воспроизводства или нормального функционирования, достигает критического значения, при котором заметно нарушаются функции пораженных органов. Зависимость тяжести нарушения от величины дозы облучения показана в Табл.4.
Табл.4. Воздействие различных доз облучения на человеческий организм.
| Доза, Гр | Причина и результат воздействия |
| (0.7 - 2)·10-3 | Доза от естественных источников в год |
| 0.05 | Предельно допустимая доза профессионального облучения в год |
| 0.1 | Уровень удвоения вероятности генных мутаций |
| 0.25 | Однократная доза оправданного риска в чрезвычайных обстоятельствах |
| 1.0 | Доза возникновения острой лучевой болезни |
| 3- 5 | Без лечения 50% облученных умирает в течение 1-2 месяцев вследствие нарушения деятельности клеток костного мозга |
| 10 - 50 | Смерть наступает через 1-2 недели вследствие поражений главным образом желудочно кишечного тракта |
| 100 | Смерть наступает через несколько часов или дней вследствие повреждения центральной нервной системы |
Эти эффекты проявляются лишь при интенсивном однократном или многократном облучении, превышающим определенный порог. При этом возникают незлокачественные локальные повреждения кожи - лучевой ожог (злоупотребление загаром так же приводит к ожогу кожи), катаракта глаз, повреждение половых клеток (кратковременная или постоянная стерилизация) и др. Время появления максимального эффекта так же зависит от дозы: после более высоких доз он наступает раньше. Нестохастические эффекты проявляются лишь при высоком или аварийном облучении всего тела и отдельных органов, причем порог возникновения эффекта зависит и от того, какой орган подвергся облучению. Реакция организма на интенсивное облучение приведена в Табл.5.
Табл.5. Значение дозы на органы и ткани, при которых возникают значимые нестохастические эффекты
| Орган, ткань | Нестохастический эффект | Доза, Зв |
| Все тело | Лучевая реакция | 0,5 |
| Все тело | Лучевая болезнь легкой степени | 1,0-1,5 |
| Все тело | Лучевая болезнь средней степени | 2,0 |
| Все тело | Лучевая болезнь тяжелой и крайне тяжелой формы | 3,0-4,0 |
| Все тело | 50% летальность в течение 60 дней | 4,0-5,0 |
| Кожа | Переходящая эритема, временная эпиляция | 3,0 |
| Легкие | Пневмония | 5,0 |
| Легкие | Смерть | 10,0 |
| Половые железы | Кратковременная стерилизация | 0,2-1,0 |
| Уровень естественного фона, Зв/год | 0,0007-0,0045 | |
| Предельная доза профессионального облучения в год (до 1996 г.) | 0,05 | |
| То же, после 1996 г. | 0,02 |
Эти дозы и эффекты применимы лишь к среднему индивидууму в популяции здоровых людей, но никак не к конкретному человеку, реакция которого может отличаться от средней. Например, у 1% населения может проявиться очень высокая радиочувствительность вследствие врожденных генетических расстройств или же других причин, ослабляющих иммунитет организма.
Хроническое облучение слабее действует на живой организм по сравнению с однократным облучением в той же дозе, что связано с постоянно идущими процессами восстановления радиационных повреждений. Считается, что примерно 90% радиационных повреждений восстанавливается.
Стохастические (вероятностные) эффекты, такие как злокачественные новообразования, генетические нарушения, могут возникать при любых дозах облучения. С увеличением дозы повышается не тяжесть этих эффектов, а вероятность (риск) их появления. Для количественной оценки частоты возможных стохастических эффектов принята консервативная гипотеза о линейной беспороговой зависимости вероятности отдаленных последствий от дозы облучения с коэффициентом риска около 7 ·10-2 /Зв. (Табл.6).
Табл.6. Число случаев на 100 000 человек при индивидуальной дозе облучения 10 мЗв.
| Категории облучаемых | Смертельные случаи рака | Несмертельные случаи рака | Тяжелые наследуемые эффекты | Суммарный эффект: |
| Работающий персонал | 4.0 | 0.8 | 0.8 | 5.6 |
| Все население* | 5.0 | 1.0 | 1.3 | 7.3 |
*Все население включает не только как правило здоровый работающий персонал, но и критические группы (дети, пожилые люди и т.д.)
Основными стохастическими эффектами являются канцерогенные и генетические. Поскольку эти эффекты имеют вероятностный характер и длительный латентный (скрытый) период, измеряемый годами и десятками лет после облучения, они трудно обнаруживаемы. К канцерогенным эффектам относятся поражения крови, кроветворных органов, новообразования и опухоли. Генетические эффекты - врожденные физические и психические уродства и ряд других тяжелых заболеваний - возникают в результате мутаций и других нарушений в половых клеточных структурах, ведающих наследственностью. Выход обоих эффектов мало зависит от мощности дозы, а определяется суммарной накопленной дозой, т.е. он будет выше даже в местностях с естественным повышенным радиационным фоном. Выявление и тем более предсказание появления эффекта у отдельного человека практически непредсказуемо. Выход их определяется коллективной дозой, если она составляет не менее 1000 чел. Зв; при значении в первые единицы чел. Зв эффект облучения (онкогенные и генетические заболевания) на фоне спонтанных или обусловленных общетоксическими факторами, выявить невозможно (Табл. 7).
Табл. 7. Коллективная доза, необходимая для получения 95% вероятности обнаружения увеличения частоты развития раковых опухолей
| Контингент, заболевание | Чел.Зв | Период наблюдения, лет | Контингент, заболевание | Чел.Зв | Продолжи-тельность наблюдения, лет |
|
Дети |
Взрослые |
||||
| Лейкомия | 3100 | 10 | Лейкомия | 1000 | 20 |
| Рак щитовидной железы | 7000 | 10 | Рак молочной железы | 4200 | 20 |
| Прочие виды рака | 3100 | 10 | Прочие виды рака | 120000 | 20 |
Лучевая болезнь возникает при воздействии на организм ионизирующих излучений в дозах, превышающих предельно допустимые. У человека возможны молниеносная, острая, подострая и хроническая. Лучевая болезнь проявляется поражением органов кровотворения, нервной системы, желудочно-кришечного тракта и др.
 Наиболее важным следствием летального повреждения клеток при облучении в высоких дозах является развитие острой лучевой болезни, ОЛБ. В ее патогенезе ведущая роль принадлежит прямому радиационному поражению клеток критических систем. Основные формы острой лучевой болезни и дозы, после облучения в которых они развиваются, представлены в
Табл.8. В зависимости от дозы облучения в роли критических выступают разные системы, что и определяет, какая клиническая форма ОЛБ разовьется после облучения в том или ином диапазоне доз. Какая именно система оказывается в конкретных условиях критической, зависит как от уровня их радиочувствительности, так и от скорости развития смертельных исходов при несовместимом с жизнью повреждении данной системы.
Наиболее важным следствием летального повреждения клеток при облучении в высоких дозах является развитие острой лучевой болезни, ОЛБ. В ее патогенезе ведущая роль принадлежит прямому радиационному поражению клеток критических систем. Основные формы острой лучевой болезни и дозы, после облучения в которых они развиваются, представлены в
Табл.8. В зависимости от дозы облучения в роли критических выступают разные системы, что и определяет, какая клиническая форма ОЛБ разовьется после облучения в том или ином диапазоне доз. Какая именно система оказывается в конкретных условиях критической, зависит как от уровня их радиочувствительности, так и от скорости развития смертельных исходов при несовместимом с жизнью повреждении данной системы.
Табл.8. Острая лучевая болезнь от внешнего облучения (Клинические формы и степени тяжести)
| Клиническая форма | Степень тяжести | Доза, Гр ( ± 30 %) |
| Костномозговая | 1 (легкая) | 1 - 2 |
| Костномозговая | 2 (средняя) | 2 – 4 |
| Костномозговая | 3 (тяжелая) | 4 – 6 |
| Переходная | 4 (крайне тяжелая) | 6 - 10 |
| Кишечная | - “ - “ - “ - | 10 – 20 |
| Токсемическая (сосудистая) | - “ - “ - “ - | 20 – 80 |
| Церебральная | - “ - “ - “ - | > 80 |
Другими последствиями летального повреждения большого числа клеток являются: хроническая лучевая болезнь, дерматит, пневмонит и т.п. Отрицательные последствия облучения в невысоких дозах связаны с нелетальными повреждениями клеток, с возникновением передающихся по наследству повреждений генетического аппарата, следствием которых может оказаться возникновение злокачественных новообразований или генетические аномалии у потомков облученных родителей.
Лучевую болезнь можно подразделить на острую и хроническую.
Острая лучевая болезнь. Тяжесть течения острой лучевой болезни зависит от дозы облучения:
Церебральная форма (свыше 80 грэй смерть на 1-3 сут после облучения)
Токсемическая форма (20-80 грэй, смерть на 4-7 сут после облучения).
Кишечная форма (10-20 грэй, смерть на 16-18 сут в результате интоксикации продуктами кишечного содержимого).
Костно-мозговая (типичная) форма - 1-10 грэй, летальность 50%; 4 стадии в течение этой формы:
а) стадия первичной общей реактивности (первые минуты): тошнота, рвота, недомогание, уменьшение АД, нейтрофильный лейкоцитоз, начальные признаки лимфопении.
б) стадия кажущегося клинического благополучия: субъективное улучшение состояния, усилении лимфопении, нейтропения, снижение количества ретикулоцитов, тромбоцитов, гипоплазия костного мозга.
в) стадия выраженных клинических проявлений: анемический синдром; геморрагический синдром; развитие инфекции: пневмония; кишечный синдром; изменение электролитного баланса
г) стадия восстановления
Чем больше поглощенная доза радиации, тем раньше наблюдается клиническое проявление и тем оно выраженнее по степени лимфопении и времени ее наступления.
Хроническая лучевая болезнь. Это общее заболевание организма, развивающееся в результате длительного действия ионизирующего излучения в относительно малых, но превышающих допустимые уровни дозах. Характерно поражение различных органов и систем.
В соответствии с современной классификацией хроническая лучевая болезнь может быть вызвана:
а) воздействием общего внешнего излучения или радиоактивных изотопов с равномерным распределением их в организме;
б) действием изотопов с избирательным депонированием либо местным внешним облучением.
В развитии хронической лучевой болезни выделяют три периода:
1) период формирования, или собственно хроническая лучевая болезнь;
2) период восстановления;
3) период последствий и исходов лучевой болезни.
Первый период, или период формирования патологического процесса, составляет примерно 1 - 3 года – время, необходимое для формирования при неблагоприятных условиях труда клинического синдрома лучевой болезни с характерными для него проявлениями. По выраженности последних различают 4 степени тяжести: I – легкую, II – среднюю, III – тяжелую и IV – крайне тяжелую. Все 4 степени являются лишь разными фазами единого патологического процесса.
Второй период, или период восстановления, определяется обычно через 1 - 3 года после прекращения облучения или при резком снижении его интенсивности. В этот период можно четко установить степень выраженности первично-деструктивных изменений и составить определенное мнение о возможности репаративных процессов. Заболевание может закончиться полным восстановлением здоровья, восстановлением с дефектом, стабилизацией бывших ранее изменений или ухудшением (прогрессирование процесса).
Патологоанатомическая картина. При хронической лучевой болезни происходят структурные изменения в железах внутренней секреции, центральной и периферической нервных системах, желудочно-кишечном тракте. В наибольшей степени страдают органы, в которых прежде всего реализуется энергия ионизирующей радиации. При микроскопическом исследовании выявляются нарушения в органах кроветворения. В лимфатических узлах обнаруживаются изменения в центральной части фолликулов, в костном мозге – явления аплазии. Морфологически в крови в начальных стадиях болезни отмечается сочетаемость процессов деструкции и регенерации. В кроветворной ткани наряду с нарастающей очаговой гипоплазией обнаруживаются островки гиперплазии. При продолжающемся облучении на этом фоне имеют место нарушение и извращение регенерации, задержка дифференцировки и созревания клеток. В ряде органов выявляются признаки атрофии, извращение процессов регенерации. Особенностью воздействия ионизирующего излучения является его онкогенная направленность в результате мутагенного действия и общего подавления иммунной реактивности организма.
Клиническая картина. Хроническая лучевая болезнь характеризуется медленным развитием отдельных симптомов и синдромов, своеобразием симптоматики и наклонностью к прогрессированию. Ведущими симптомами являются изменения в нервной системе, кроветворном аппарате, сердечно-сосудистой и эндокринной системах, желудочно-кишечном тракте, печени, почках; происходит нарушение обменных процессов. Полиморфность и многообразие симптоматики зависят от суммарной дозы облучения, характера распределения поглощенной дозы и чувствительности организма.
Хроническая лучевая болезнь, обусловленная общим облучением, встречается у лиц, подвергающихся воздействию ионизирующей радиации в течение 3–5 лет и получивших разовую и суммарную дозы, превышающие предельно допустимые.
Одно из ранних проявлений этой формы – неспецифические реакции вегетативно-сосудистых нарушений, протекающих на фоне функционального изменения центральной нервной системы с обязательными изменениями в периферической крови. В начале заболевания отмечается лабильность показателей крови, в последующем – стойкая лейкопения и тромбоцитопения. Нередко в этот период (доклинический) появляются симптомы геморрагического диатеза. Больные предъявляют жалобы на общее недомогание, головную боль, повышенную раздражительность, кровоточивость десен, диспепсические расстройства и т. п. Однако в этот период все жалобы носят преходящий характер, а симптомы быстрообратимы.
В дальнейшем, если эта стадия не диагностирована и больной продолжает работать в условиях воздействия ионизирующего излучения, происходит формирование болезни, проходящей все этапы своего развития. Только динамическое наблюдение за лицами с признаками отдельных симптомов, подозрительных на наличие лучевой болезни, позволяет установить их клиническую сущность и причину. При дальнейшем развитии процесса появляются и прогрессируют симптомы общей астенизации организма, нарушение обменных процессов и различные нервно-трофические расстройства. Могут наблюдаться симптомы угнетения секреторной и моторной функций желудка и кишечника, снижение функции эндокринных желез (особенно половых), трофические нарушения кожи (снижение эластичности, сухость, ороговение) и ногтей. Резко снижается сопротивляемость организма, что способствует возникновению различных инфекционных осложнений. Особенностью является возможность развития лейкозов и злокачественных новообразований.
В зависимости от тяжести заболевания и клинического течения различают четыре степени тяжести хронической лучевой болезни.
Хроническая лучевая болезнь I (легкой) степени характеризуется ранним развитием функциональных обратимых нарушений неспецифического характера. По проявлению отдельных синдромов болезнь в этой стадии мало отличается от доклинического периода. Однако по мере формирования заболевания отмечается симптоматика многообразных нарушений нервно-висцеральной регуляции. Клиническая картина складывается из вегетативно-сосудистых расстройств, начальных астенических проявлений и изменений в периферической крови. Основными жалобами являются общая слабость, недомогание, головные боли, снижение работоспособности, ухудшение аппетита, нарушение сна. При объективном осмотре обращает на себя внимание: эмоциональная лабильность, стойкий красный дермографизм, дрожание пальцев вытянутых рук, неустойчивость в позе Ромберга, общий гипергидроз, лабильность пульса. Один из постоянных симптомов – функциональное нарушение желудочно-кишечного тракта в виде диспепсических явлений, дискинезии кишечника и желчных путей, хронического гастрита со снижением секреторной и моторной функций желудка. Кровоточивость в этой стадии незначительна. Имеет место нарушение функции эндокринных желез – половых и щитовидной: у мужчин отмечается импотенция, у женщин – нарушение овариально-менструальной функции. Гематологические показатели отличаются лабильностью. Прежде всего изменяется содержание лейкоцитов с отчетливой тенденцией к лейкопении в результате уменьшения числа нейтрофилов при относительном лимфоцитозе. При исследовании костного мозга выявляются признаки раздражения красного ростка кроветворения и белого (незначительное увеличение количества незрелых клеток миелоидного ряда), а также увеличение числа плазматических клеток. Заболевание отличается благоприятным течением, возможно полное клиническое выздоровление.
Хроническая лучевая болезнь II (средней) степени проявляется дальнейшим развитием астеновегетативных нарушений и сосудистой дистонии, угнетением функции кроветворного аппарата и выраженностью геморрагических явлений. По мере прогрессирования заболевания у больных отмечается выраженный астенический синдром, сопровождающийся головными болями, головокружением, повышенной возбудимостью и эмоциональной лабильностью, снижением памяти, ослаблением полового чувства и потенции. Более выраженными становятся трофические нарушения: дерматиты, выпадение волос, изменение ногтей. Возможны диэнцефальные кризы с кратковременной потерей сознания, приступы пароксизмальной тахикардии, озноб и обменные нарушения.
Со стороны сердечно-сосудистой системы отмечаются стойкая гипотония с преимущественным снижением диастолического давления, расширение границ сердца, приглушенность сердечных тонов. Усиливается кровоточивость, которая обусловлена как повышением проницаемости сосудистых стенок, так и изменениями в крови (снижение ее свертываемости). Наблюдаются кровоизлияния в кожу и слизистые оболочки, геморрагические гингивиты и стоматиты, множественные кожные петехии, носовые кровотечения. Оказывается нарушенной моторика желудка со снижением секреции, изменена ферментативная деятельность поджелудочной железы и кишечника; возможно токсическое поражение печени. Наибольшие изменения при данной степени хронической лучевой болезни появляются в крови. Наблюдается резкое снижение уровня лейкоцитов (до 2,0·103/л и ниже), причем лейкопения носит стойкий характер. Более выраженными становятся признаки токсической зернистости и дегенеративных изменений нейтрофилов, тромбоцитопения. В костном мозге отмечается гипоплазия всех видов кроветворения. Заболевание носит стойкий характер.
Хроническая лучевая болезнь III (тяжелой) степени характеризуется тяжелыми, подчас необратимыми, изменениями в организме с полной потерей регенерационных возможностей тканей. Отмечаются дистрофические нарушения в различных органах и системах. Клиническая картина носит прогрессирующий характер. Болезнь может протекать длительно, могут присоединиться такие осложнения, как инфекция, травма, интоксикация. Ведущие симптомы этой формы заболевания – тяжелые поражения нервной системы и глубокое угнетение всех видов кроветворения. Больные резко астеничны, жалуются на значительную общую слабость, адинамию, постоянную головную боль, которая сопровождается приступами головокружения, тошнотой или рвотой. Появляются упорная бессонница, частые кровотечения; снижена память. Нередко выявляются признаки диффузного поражения головного мозга по типу рассеянного энцефаломиелита с изменениями двигательной, рефлекторной и чувствительной сфер. Появляются множественные геморрагии, язвенно-некротические процессы на слизистых оболочках. На месте кровоизлияний – бурая пигментация кожи. Наблюдается массивное выпадение волос, наступает полное облысение. Расшатываются и выпадают зубы. Некротические изменения можно наблюдать также на миндалинах и в гортани.
Жалобы больных на одышку, приступы сердцебиение и тупые боли в области сердца находят объективное подтверждение при осмотре. Границы сердца расширены, выслушиваются глухое тоны. На ЭКГ – глубокие дистрофические изменения в мышце сердца. Резко снижается аппетит, что сочетается с диспепсическими расстройствами и геморрагическими явлениями. Определяются глубокие обменные изменения, нарушения в эндокринной системе (в надпочечниках, гипофизе, половых железах, щитовидной железе). При биохимических исследованиях крови обнаруживается снижение всех показателей обменных процессов. Обращают на себя внимание глубокие нарушения со стороны кроветворного аппарата вследствие резкой гипоплазии костного мозга. Количество лейкоцитов в периферической крови резко падает (до 1,0·109/л). Лимфоциты иногда не определяются. Значительно снижено число тромбоцитов (до 3 Г/л и менее). Все клетки белой крови дегенеративно изменены. Результаты исследования костного мозга свидетельствуют о резком обеднении его клеточными элементами, задержке нормального созревания костномозговых элементов, распаде клеток. Отмечено, что присоединение к данному патологическому процессу других заболеваний, особенно воспалительных, приводит к быстрому прогрессированию сдвигов в костном мозге. Это в свою очередь становится причиной резкого ослабления сопротивляемости организма и создания условий для начала тяжелого сепсиса.
При хронической лучевой болезнь IV степени происходит быстрое и неуклонное нарастание всех болезненных симптомов (аплазия костного мозга, резко выраженные явления геморрагии, развитие тяжелого сепсиса). Прогноз неблагоприятный (летальный исход).
Диагноз. Диагностировать хроническую лучевую болезнь очень трудно, особенно в ранней стадии. Ни один из выявляемых в этом периоде симптомов не обладает специфичностью. Симптомы вегетососудистой дистонии, явления астении, умеренная лейкопения, артериальная гипотензия, снижение желудочной секреции – все это может быть обусловлено рядом разнообразных причин, не имеющих отношения к воздействию ионизирующей радиации. При постановке диагноза большое значение следует придавать санитарно-гигиенической характеристике условий труда и профессиональному анамнезу обследуемого. Определенную ценность представляют данные динамических наблюдений и результаты дозиметрии, а также количественное определение радиоактивных веществ в выделениях организма: не только в моче и кале, но и в слюне, мокроте, желудочном соке.
Лечение. Больным хронической лучевой болезнью необходимо проводить комплексное лечение в зависимости от степени выраженности заболевания. При ранних проявлениях болезни назначают щадящий режим и общеукрепляющие мероприятия: пребывание на воздухе, лечебная гимнастика, полноценное питание, витаминизация. Широко должны применяться физические методы лечения: водные процедуры, гальванический воротник, гальваноновокаинтерапия. Из седативных средств назначают бром, а также кальция глицерофосфат, фитин, фосфрен, пантокрин, женьшень и т. д. Если поражен кроветворный аппарат, показаны средства, стимулирующие кроветворение. При неглубоких и нестойких нарушениях кроветворения назначают витамин В12 в комбинации с натрия нуклеинатом или лейкогеном. Витамины В12 рекомендуется вводить внутримышечно по 100–300 мкг в течение 10 дней. В дальнейшем проводят симптоматическую терапию.
При лучевой болезни II (средней) степени, особенно в период обострения, рекомендуется лечение в стационаре. Помимо общеукрепляющих и симптоматических средств, применяют стимуляторы лейкопоэза (витамин B12, тезан, пентоксил, натрия нуклеинат), антигеморрагические препараты (аскорбиновая кислота в больших дозах, витамины В6, Р, К; препараты кальция, серотонин), анаболические гормоны (неробол) и т.д. Если присоединяются инфекционные осложнения, вводят антибиотики. При тяжелых формах лучевой болезни лечение должно быть упорным и длительным. Главное внимание уделяют борьбе с гипопластическим состоянием кроветворения (многократные гемотрансфузии, трансплантация костного мозга), инфекционными осложнениями, трофическими и обменными нарушениями (гормональные препараты, витамины, кровезаменители) и т. д. Чрезвычайно сложная задача – выведение из организма радиоактивных инкорпорированных веществ. Так, при наличии в организме осколков урана используют щелочи, мочегонные и адсорбирующие средства. Рекомендуются также специальные диеты: щелочная – при инкорпорировании урана, магниевая – при инкорпорировании стронция. Для связывания и ускорения выведения изотопов назначают комплексоны (тетацин-кальций, пентацин). При стойком астеническом синдроме показано лечение в условиях санатория общесоматического типа.
Рак - наиболее серьезное из всех последствий облучения человека при малых дозах. Обширные обследования, охватившие 100000 человек, переживших атомные бомбардировки Хиросимы и Нагасаки, показали, что пока рак является единственной причиной повышенной смертности в этой группе населения.
Замечание. Многолетние наблюдения за пострадавшими в Хиросиме и Нагасаки не выявили злокачественных новообразований при дозах ниже 20 сГр.
Несмотря на многочисленные исследования, оценка вероятности заболевания людей раком в результате облучения не надежна. Имеется масса полезных сведений, полученных в экспериментах на животных, однако, несмотря на их очевидную пользу, они не могут заменить сведения о действии радиации на человека. Для того чтобы оценка риска заболевания раком для человека была достаточно надежна, полученные в результате обследования людей сведения должны удовлетворять целому ряду условий. Должна быть известна величина поглощенной дозы. Излучение должно равномерно попадать на все тело либо на ту его часть, которая изучается в настоящий момент. Облученное население должно проходить обследования регулярно в течение десятилетий, чтобы успели проявиться все виды раковых заболеваний. Диагностика должна быть достаточно качественной, позволяющей выявить все случаи раковых заболеваний. Важно иметь хорошую «контрольную» группу людей, сопоставимую во всех отношениях (кроме самого факта облучения) с группой лиц, за которой ведется наблюдение, чтобы выяснить частоту заболевания раком в отсутствие облучения. И обе эти популяции должны быть достаточно многочисленны, чтобы полученные данные были статистически достоверны. Ни один из имеющихся материалов не удовлетворяет полностью всем этим требованиям.
Неопределенность состоит в том, что почти все данные о частоте заболевания раком в результате облучения получены при обследовании людей, получивших относительно большие дозы облучения -1 Гр и более. Имеется весьма немного сведений о последствиях облучения при дозах, связанных с некоторыми профессиями, и совсем отсутствуют прямые данные о действии доз облучения, получаемых населением Земли в повседневной жизни. Поэтому нет никакой альтернативы такому способу оценки риска населения при малых дозах облучения, как экстраполяция оценок риска при больших дозах (не вполне надежных) в область малых доз облучения. НКДАР ООН в своих оценках опирается на два основных допущения, которые пока что вполне согласуются со всеми имеющимися данными. Согласно первому допущению, не существует никакой пороговой дозы, за которой отсутствует риск заболевания раком. Любая сколь угодно малая доза увеличивает вероятность заболевания раком для человека, получившего эту дозу, и всякая дополнительная доза облучения еще более увеличивает эту вероятность.
 Второе допущение заключается в том, что вероятность, или риск, заболевания возрастает прямо пропорционально дозе облучения: при удвоении дозы риск удваивается, при получении трехкратной дозы - утраивается и т.д. (Рис. 3). НКДАР полагает, что при таком допущении возможна переоценка риска в области малых доз, но вряд ли возможна его недооценка. На такой заведомо "несовершенной", но удобной основе и строятся все приблизительные оценки риска заболевания различными видами рака при облучении.
Второе допущение заключается в том, что вероятность, или риск, заболевания возрастает прямо пропорционально дозе облучения: при удвоении дозы риск удваивается, при получении трехкратной дозы - утраивается и т.д. (Рис. 3). НКДАР полагает, что при таком допущении возможна переоценка риска в области малых доз, но вряд ли возможна его недооценка. На такой заведомо "несовершенной", но удобной основе и строятся все приблизительные оценки риска заболевания различными видами рака при облучении.
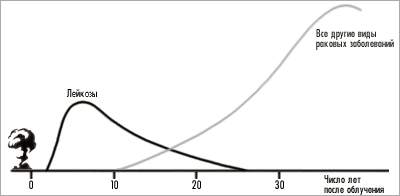
Рис. 3. Вероятность заболевания раком
Относительная среднестатистическая вероятность заболевания раком после получения однократной дозы в один рад ( = 0,01 Гр) рассчитана для равномерного облучения всего тела. На графике, построенном на основании результатов обследования людей, переживших атомную бомбардировку, показано ориентировочное время появления злокачественных опухолей с момента облучения. Видно, что после двухлетнего скрытого периода развиваются лейкозы, достигая максимальной частоты через шесть-семь лет; затем частота плавно уменьшается и через 25 лет становится практически равной нулю. Солидные (сплошные) опухоли начинают развиваться через 10 лет после облучения, но исследователи не располагают пока достаточной информацией, позволяющей построить всю кривую.
Еще в 30-тых годах 19-го века было обнаружено, что рентгеновские лучи вызывают повышенную частоту появления мутантных потомков у дрозофил, родителей которых подвергали облучению. К 60-м годам были сформулированы некоторые общие принципы действия радиации на живые системы -
принцип отсутствия пороговой дозы;
принцип накопления дозы в течение жизни особи;
принцип удваивающей дозы.
Первый принцип свидетельствует, что абсолютно безопасных для живых организмов доз излучения не существует и любое радиационное воздействие может вызвать генетические изменения у потомков облученного родителя. Суть второго принципа состоит в том, что дозы, полученные организмом в течение жизни накапливаются, поэтому, чем больше ее продолжительность, тем более тяжелые последствия как для организма, так и его потомства следует ожидать.
Принцип удваивающей дозы введен для сопоставления относительного эффекта генетических нарушений, возникших в результате естественного мутационного процесса и индуцированного радиационным воздействием. Так, для растений количество энергии, необходимое для удвоения количества мутаций по сравнению с естественным уровнем мутирования, лежит в диапазоне 8-390 рад. Размер удваивающей дозы для человека был оценен в 10 рад.
Все эти данные были получены в опытах на дрозофиле. Их попытались перенести на млекопитающих, и, естественно, человека. Считалось, что закономерности радиационного мутагенеза, установленные на дрозофиле, имеют универсальный характер. Некоторые Эксперименты, проведенные на млекопитающих, пошатнули эту идею. Самцов мышей облучали в трех поколениях. В каждом поколении самцы получали дозу 350 рентген. Однако влияния этих облучений на продолжительность жизни потомства обнаружить не удалось. Не было найдено генетических изменений и после облучения животных большими дозами - от 500 до 720 рентген. Не смотря на огромные усилия не удалось выявить какого-то значимого нарушения в кариотипах людей (т.е. генетических последствий), пострадавших от взрывов атомных бомб в Японии и их потомков. Цитологические исследования, проведенные в Японии у детей, родители которых уцелели после взрывов атомных бомб в Хиросиме и Нагасаки (анализировали семьи, в которых один из родителей был облучен дозой не менее 100 рад и имевшие детей, рожденных до и после взрыва, было исследовано 185 детей из 98 семей, в которых 57 детей появились до взрыва бомбы, а 128 – после) показали, что кариотипы детей оказались нормальными, за исключением трех случаев, которые были связаны с генетическими нарушениями, возникшими до взрыва. Международные коллективы генетиков и врачей обследовали 72216 детей, родители которых пережили бомбардировку, и не выявили ни увеличения числа случаев врожденных дефектов, ни аномалий хромосом, ни увеличения количества раковых заболеваний по сравнению с нормой. Единственным эффектом, о котором можно говорить с уверенностью, является то обстоятельство, что у людей, облученных в широком диапазоне доз (1-1700 р) в результате взрыва атомных бомб, при авариях в профессиональных условиях или облученных с терапевтическими целями, могут возникнуть изменения только в соотношениях полов у потомства облученных.
В последующие годы исследования европейских, американских и японских исследователей так же не подтвердили концепцию о глобальном влиянии радиационного воздействия на генетический аппарат. Надежды ярых радиофобов, что Чернобыльский инцидент приведет к многочисленным генетическим последствиям, не оправдались: мутаций у человека обнаружить не удалось (Прогностические оценки отдаленных радиологических последствий Чернобыля показали, что выход злокачественных новообразований и врожденных заболеваний будет находиться в пределах естественного уровня).
К концу 20-го века были накоплены гигантские по масштабам результаты исследований о влиянии радиации на «чистую»» ДНК, белки, изолированные клетки и организмы - от бактерий до человека. Но общей концепции влияния радиации на живые существа не было создано. Накопленные данные оказались достаточно абстрактны и собрать их воедино трудно, почти невозможно, потому что в разных экспериментах использовали разные виды животных, разные дозы и мощности излучений и разные параметры оценки последствий, в том числе и генетических.
К началу 21-го века генетики убедились в необходимости пересмотра многих положений, укрепившихся в радиационной генетике 30-50 годов. Первая методологическая ошибка заключалась в том, что выводы о последствиях облучений, экстраполированные на человека, были получены в экспериментах на дрозофиле. Впоследствии оказалось, что особенности метаболизма насекомых и млекопитающих глубоко различны, поэтому утверждение «что справедливо для дрозофилы справедливо и для человека» по меньшей мере некорректно. Более того, у самцов дрозофилы отсутствует такой процесс, как кроссинговер, и, соответственно, репарационные системы, эффективно защищающие генеративные клетки млекопитающих от неблагоприятных воздействий, у данного вида насекомых не функционируют, поэтому уровень реального мутационного процесса у разных типов животных сравнивать зачастую невозможно. Кроме того, человеческая популяция высоко гетерозиготна и по этой причине так же трудно сравнивать генетические последствия облучения для популяций и чистых линий.
В проекте «Грандиозная мышь» (США) количество использованных животных составило почти 7 миллионов особей. Результаты этой грандиозной работы показали: 1) Различия в индивидуальной чувствительности разных особей к радиационному воздействию достигали 20-кратных значений. 2) Если доза радиации растягивается во времени, то одномоментное облучение вызывает более значительный эффект, чем та же доза, полученная через определенные периоды - то есть на протяжении времени доза не накапливается и принцип кумулирования дозы, установленный на дрозофиле, на млекопитающих не распространяется. 3) Особи мужского пола более чувствительны к радиационным последствиям облучения, чем самки. 4) Чем больше промежуток времени между временем облучения и оплодотворением, тем меньшее количество мутаций вызывает радиация у потомства. Для млекопитающих и, в частности, человека, достаточно шести месяцев, чтобы свести до минимума генетические последствия, вызванные радиационным воздействием. Расчеты показывают, что удвоение частоты самопроизвольных, спонтанных мутаций находится в диапазоне 0,5-2,5 Зв (1 Зиверт (Зв) соответствует поглощенной дозе в 1 Дж/кг. 0,01 Зв = 1 бэр). На дрозофиле величина удваивающей дозы была установлена на уровне 0,05 Зв. Таким образом, в отличие от дрозофилы, данные, полученные на млекопитающих в течение почти 30-летнего эксперимента «характеризуют радиацию как слабый мутаген в отношении млекопитающих».
Все вышесказанное вовсе не должно убеждать, что радиационное воздействие безопасно для человека. Однако необходимо различать, как это принято для большинства физических и химических факторов, с которыми контактирует человечество в техногенной среде, биологические последствия их воздействий, которые зависят от мощности дозы и продолжительности контакта.
Сейчас накопилось немало примеров двойственных эффектов воздействия радиации на людей. В 30-40 годы около 14000 человек страдали от болезни, которая называется анкилозирующий спондилит (дегенеративная деформация позвоночника), которая сопровождается очень сильными болями. Облучение высокими дозами радиации снимало болевой синдром и в течение многих лет пациенты не испытывали нужду в использовании других болеутоляющих препаратов. Наблюдение за этими пациентами показало, что 70 человек умерли от лейкоза, в то время, как в контрольной выборке на 14000 человек выявлено всего два подобных случая. У врачей и пациентов всегда стоит проблема выбора меньшего из зол - то ли страдать всю жизнь от невыносимой боли, то ли рискнуть, избрав облучение в надежде, что судьба убережет от случая попасть в 0,5% рискующих заболеть лейкозом.
В течение нескольких десятилетий существуют два направления в радиобиологии, спор между которыми никак не закончится чьей-либо победой. Причина - разные подходы к оценке влияния на биоту малых доз радиации. Первый подход постулирует, что проблемы малых доз не существует и все закономерности больших доз можно экстраполировать на малые. Второй - малые дозы по эффекту принципиально отличаются от больших, поэтому методология их изучения должна отличаться от общепринятой в современной радиобиологии.
Отсутствие мутаций можно ожидать только при полном отсутствии радиационного фона. Однако средняя годовая эффективная эквивалентная доза от естественных источников радиации составляет 2 миллизиверта , причем в разных районах земного шара эта величина варьирует от 0.3 мЗв в Европе и Японии до 250 мЗв в Бразилии, недалеко от Сан-Паулу. Для сравнения дозы радиации излучаемой источниками, которые используются в медицине, составляют основную часть излучений техногенных источников радиации около 0.4 мЗв в год. Так что, по определению, полностью освободиться от естественной радиации, а, следовательно, и избавиться полностью от мутационного процесса, как об этом мечтают экстремисты радиологии, никогда не удастся.
Понятие «радиационный гормезис» было введено в биологию в 80- годы и, как в гомеопатии, постулировало, что если большие дозы радиации оказывают неблагоприятные эффекты на живые организмы - угнетают деление клеток, рост и развитие, то малые дозы стимулируют практически все физиологические процессы. Конкретные величины малых доз зависят от видовой характеристики, для млекопитающих они лежат в диапазоне до 0.5 Гр. Эксперименты свидетельствуют о том, что под влиянием малых доз ионизирующих излучений естественная продолжительность жизни животных увеличивается на 10-12% по сравнению с адекватным контролем. Сторонники идеи радиационного гормезиса не без оснований считают, что атомная радиация является естественным, постоянно действующим на организм фактором, без которого нормальное существование невозможно. как невозможна жизнь без гравитации, магнитного поля или кислорода.
Не всегда последствия воздействия ионизирующих излучений неблагоприятны для организма. Естественный радиационный фон - не только один из важнейших факторов эволюции живого на Земле, но и необходимое условие существования биологических объектов. Имеется физиологический уровень воздействия излучений, благоприятный для жизнедеятельности. Если культуру парамеций изолировать от радиационных воздействий в свинцовом контейнере, в ней резко замедляется процесс деления клеток. После помещения в контейнер с культурой радиоактивного источника, воспроизводящего фоновый уровень радиации, митотическая активность нормализуется.
Существование такого парадоксального явления как радиационный гормезис подтверждено в разных лабораториях и на различных объектах. Гамма облучение в малых дозах стимулирует прорастание семян, вызывает увеличение вегетативной массы растений. Малые дозы активируют иммунную систему у разных видов животных и ключевые мембранно- связанные ферменты, в частности аденилатциклазу, активируют репарационные системы и повышают устойчивость клеток и организма к последующим более высоким дозам облучения.
Поразительное противоречие между издревле широко используемыми в бальнеологии радоновыми ваннами, целебные эффекты которых никто не подвергает сомнению и опасностью радонового облучения давно обсуждается в медицинской и биологической литературе, однако прийти к какому-либо пониманию механизмов этих эффектов вряд ли будет возможно вне идей радиационного гормезиса.
Сокращение продолжительности жизни животных, содержащихся при повышенном уровне воздействия ионизирующих излучений, наблюдалось лишь при суточных дозах, превышавших 0,01 Гр. При меньших уровнях доз, продолжительность жизни даже существенно повышалась. Ежедневное облучение крыс на протяжении всей жизни гамма лучами в дозе 8 мГр привело к повышению продолжительности их жизни на 25 - 30 %. Облучение грудной клетки обезьян в дозе 1 Гр повышало устойчивость животных к дифтерийному токсину. Облучение мышей в дозах 0,05 - 2 Гр понижало их летальность после заражения вирусом инфлуенцы свиней. После облучения грызунов в дозах до 1 Гр повышалась фагоцитарная активность нейтрофилов, активировался антителогенез.
Эти свойства малых доз излучения проявились и у человека при применении радоновых ванн или при приеме внутрь радоновой воды, когда отмечалась активация иммунных механизмов, и возникало общестимулирующее действие на организм, улучшение разных видов обмена, снижение артериального давления и другие благоприятные эффекты.
Важным проявлением радиационного гормезиса является феномен так называемого адаптивного ответа, заключающийся в повышении устойчивости различных биологических объектов к воздействию поражающих доз радиации в случае предварительного облучения в малой (порядка 1 сГр) дозе. Этот эффект проявляется при облучении клеток по выходу хромосомных аберраций, по выходу мутаций, при облучении животных по критериям, характеризующим поражение критических систем, по выживаемости животных и т.д.
Стимулирующие эффекты малых доз облучения используются в хозяйственной деятельности. Это облучение куриных яиц в периоде инкубации, приводящее к повышению вылупляемости цыплят, ускорению полового созревания кур, повышению их яйценоскости, а также предпосевное облучение семян, повышающее их всхожесть и урожайность и др.
Эффекты, связанные с проявлением стимулирующего действия малых доз облучения, получили наименование радиационного гормезиса.
Проявления стимулирующих эффектов малых доз свидетельствуют о повышении при их воздействии надежности механизмов гомеостаза, в частности, за счет адаптивной (в ответ на повреждение клеток) активации восстановительных процессов в разных системах.
Если гибель клетки после облучения связана, в первую очередь, с повреждением уникальных генетических структур, то в реализации стимулирующего действия радиации большее значение имеет оживление регуляторных метаболических процессов, связанных с мембранными структурами.
Одним из вероятных механизмов, по которым включается эффект гормезиса, является индукция при воздействии малых доз систем репарации ДНК. Благодаря этому могут устраняться не только индуцированные облучением, но и спонтанные повреждения ДНК, что, например, может привести к снижению вероятности развития рака, вызванного не только облучением, но и другими воздействиями.
Наличие феномена радиационного гормезиса позволяет предположить, что риск возникновения рака при малых дозах облучения может реально оказаться ниже, чем принятый сейчас по данным оценки, проведенной на основании экстраполяции с высоких доз (1 случай на 20 чел.-Зв).
Существуют факторы, способные изменять (ослаблять или усиливать) радиочувствительность клеток, тканей и организма в целом. Они называются радиомодифицирующими агентами.
Радиомодификация - искусственное ослабление или усиление реакций биологических объектов на действие ионизирующих излучений; способ управления радиочувствительностью с помощью изменения условий, в которых происходит облучение того или иного организма.
Радиобиологическим эффектом можно управлять двумя способами: введением в организм чуждых ему веществ (например, радиопротекторов) и направленным стимулированием защитных функций организма (введение веществ, свойственных данному организму, гипоксия и др. Радиозащитные средства - средства защиты от поражающего действия ионизирующего излучения. Они могут быть химическими, биологическими или физическими.
В настоящее время не известны вещества, способные полностью защитить человека от действия излучения, но есть частично защищающие организм от излучения. К ним относятся, например, азид и цианид натрия, вещества содержащие сульфогидридные группы и т.д. Они входят в состав радиопротекторов.
Радиопротекторы - вещества, введение которых перед облучением в среду с биологическими объектами или в организм животных и человека снижает поражающее действие ионизирующего излучения.
Радиопротекторы частично предотвращают возникновение химически активных радикалов, которые образуются под воздействием излучения. Механизмы действия радиопротекторов различны. Одни из них вступают в химическую реакцию с попадающими в организм радиоактивными изотопами и нейтрализуют их, образуя нейтральные вещества, легко выводимые из организма. Другие имеют отличный механизм. Одни радиопротекторы действуют в течение короткого промежутка времени, время действия других более длительное. Существует несколько разновидностей радиопротекторов: таблетки, порошки и растворы.
Радиопротекторы - достаточно вредные для организма вещества, поэтому им ищут замену, в частности, замены на вещества, свойственные организму или на пищевые добавки.
Некоторые пищевые вещества обладают профилактическими радиозащитным действием или способностью связывать и выводить из организма радионуклиды. К ним относятся полисахариды (пектин, декстрин, липополисахариды, находящиеся в листьях винограда и чая), фенильные и фитиновые соединения, галлаты, серотанин, этиловый спирт, некоторые жирные кислоты,микроэлементы, витамины, ферменты, гормоны. Радиоустойчивость организмов повышают некоторые антибиотики (биомицин, стрептоцин), наркотики (нембутал, барбамил).
К очень важным радиозащитным соединениям относятся «витамины противодействия». В первую очередь это относится к витаминам группы В и С. Хотя по мнению специалистов одна аскорбиновая кислота не обладает защитным действием, но она усиливает действие витаминов В и Р. В то время как ионизирующие излучения разрушают стенки кровеносных сосудов, совместное действие витаминов Р и С восстанавливает их нормальную эластичность и проницаемость. Излучение разрушает кровь, снижают количество эритроцитов и активность лейкоцитов, а витамины В1, В3, В6, В12 улучшают регенерацию кроветворения, ускорение восстановления эритроцитов и лейкоцитов. Если излучение снижает свертываемость крови, то витамины Р и К1 нормализуют протромбиновый индекс. Несколько повышает устойчивость организма к развитию лучевой болезни парааминобензойная кислота, улучшает показатели крови, способствует восстановлению веса биотин (витамин Н).
Фенольные соединения растений ученые определяют как наиболее перспективные источники потенциально активных противолучевых средств. Фенольные соединения - это биологически активные вещества лечебно - профилактического действия, необходимые для поддержания жизни и сохранения здоровья. Они повышают прочность кровеносных сосудов, регулируют работу желез внутренней секреции. Например, хорошо лечит местные лучевые повреждения кожи прополис (пчелиный клей), что главным образом связано с его фенольными компонентами. Из многочисленного ряда фенольных веществ наибольший интерес вызывают флавоноиды, способствующие удалению радиоактивных элементов из организма.
Источниками флаваноидов являются мандарины, черноплодная рябина, облепиха, боярышник, пустырник, бессмертник, солодка. Этиловый спирт обладает выраженным профилактическим радиозащитным действием на разнообразные организмы: человека, животных, бактерий. При введении в питательную смесь этилового спирта выживаемость бактерий повышается на 11 - 18%, спирт защищает от гибели почти всех мышей, облученных рентгеновскими лучами в дозе 600 рентген.
Угнетенное кроветворение - одно из наиболее серьезных последствий радиационного облучения человека. Поэтому в терапии лучевых поражений чрезвычайно важную роль играют процедуры и лекарственные средства, способные восстановить кроветворные функции организма. Для этого применяют пересадку костного мозга, переливание крови, а также препараты, приготовленные на основе экстрактов разных органов и тканей животных: тимуса, селезенки, печени, костного мозга. В попытках получить наиболее эффективные средства для радиотерапии исследователи обратили внимание на животных, чей организм особенно устойчив к облучению. Обнаружены корреляции между этим свойством и терапевтической эффективностью препаратов, полученных из органов и тканей таких малочувствительных к радиации животных. В этом отношении интересна среднеазиатская черепаха (Testudo horsfieldi) с ее феноменальной радиорезистентностью. Оказалось, что терапевтическим действием обладают экстракты эмбриональной печени, селезенки и клеток крови черепахи. Их инъекции облученным мышам стимулируют рост численности стволовых клеток, что способствует восстановлению кроветворных функций организма. Они обладают также иммуностимулирующим эффектом.
Существуют вещества, внутриклеточное содержание которых усиливает радиобиологический эффект. Это кислород, гидроперекиси липидов, группа хинонов, известная под названием радиотоксинов. Другие эндогенные вещества - тиолы, амины, липофильные антиоксиданты - напротив, проявляют радиозащитные свойства. Идея о зависимости лучевого эффекта от соотношения концентрации некоторых из этих веществ легла в основу концепции «эндогенного фона радиорезистентности». Целенаправленное изменение эндогенного фона радиорезистентности важно в условиях длительного облучения организма, когда предъявляются повышенные требования к безвредности применяемых радиозащитных средств.
Эндогенный – внутреннего происхождения; в медицине – происходящий от причин, лежащих во внутренней среде организма.
Ферментативное восстановление кислорода дает организму более 90% энергии, поэтому оно не может не влиять на исход радиационного поражения. Присутствие во всех биосредах делает кислород важнейшим фактором радиочувствительности организма человека. Из многообразных проявлений радиомодифицирующих свойств кислорода первым было обнаружено ослабление поражения биообъекта при снижении концентрации кислорода в окружающей среде во время облучения. Сейчас радиозащитное действие гипоксии широко известно.
При малых значениях напряжения кислорода (как, например, в тканях млекопитающих) даже незначительные изменения оксигенации сопряжены со значительными сдвигами радиочувствительности биообъектов. Напротив, при напряжении кислорода в среде, близком к его парциальному давлению в атмосферном воздухе при нормальных условиях, радиочувствительность максимальна и уже не может быть увеличена дальнейшим повышением содержания кислорода во внешней среде. Радиосенсибилизирующее действие кислорода проявляется в отягощении не только ближайших, но и отдаленных последствий облучения.
Известны следующие проявления радиомодифицирующего действия кислорода:
кислород, присутствующий в среде во время облучения, повышает чувствительность биообъектов к редкоионизирующим излучениям;
зависимость радиочувствительности биообъектов от напряжения кислорода имеет параболический характер, причем при уровнях оксигенации, характерных для биотканей, эта зависимость весьма существенна;
радиозащитная эффективность гипоксии у млекопитающих снижается по мере увеличения продолжительности гипоксического воздействия сверх 5 минут;
пострадиационная гипоксия обладает действием, усиливающим радиационное поражение биообъектов.
Для обеспечения эффективной противолучевой защиты организма путем создания газовой гипоксии необходимо значительное снижение уровня кислорода во вдыхаемом воздухе, которое неблагоприятно отражается на функциональном состоянии организма.
Более удобным для практического использования является метод снижения оксигенации тканей, основанный на нарушении их кровоснабжения. С этой целью применяют препараты, обладающие сосудосуживающим действием – индолилалкиламины и фенилалкиламины. Возможно применение индукторов гипоксии, например, оксида углерода.
Целенаправленное снижение напряжения кислорода во внутриклеточной среде может быть достигнуто путем интенсификации потребления диффундирующего в клетки кислорода в ходе процессов окислительного фосфорилирования Преимуществом такого подхода является отсутствие побочных эффектов, обусловленных угнетением биоэнергетических процессов в тканях. Одним из препаратов, интенсифицирующих клеточное дыхание при введении в организм и обладающих в связи с этим противолучевыми свойствами, является сукцинат натрия, применяемый в настоящее время в качестве действующего начала ряда пищевых добавок. Перспективным является совместное применение различных агентов, нацеленных на снижение оксигенации внутриклеточной среды – газовой гипоксии, индолилалкиламинов и сукцината натрия, а также комбинирование этих средств с меркаптоалкиламинами.
* - * - *
Таким образом, все виды ионизирующих излучений могут вызвать неблагоприятные химические и биологические реакции организма. Доза поглощенного облучения прямо зависит от типа изучения, его энергии и времени воздействия, пути облучения и химических свойств радионуклидов. Возникновение у человека различных проявлений лучевых поражений не является строго коррелируемой с поглощенной дозой величиной, а зависит от большого набора факторов, в том числе и от состояния организма. При существующих мерах радиационной безопасности риск появления стохастических эффектов ничтожен и выявление их на фоне спонтанной заболеваемости нереально. Для отдельного человека предсказать последствия облучения невозможно.