Профессор
И.Н.Бекман
Курс лекций ЯДЕРНАЯ МЕДИЦИНА
Лекция 7. ЛУЧЕВАЯ ТЕРАПИЯ
Содержание.
-
РАДИОТЕРАПИЯ
1.1 Основные принципы лучевой терапии
1.2 Методы лучевой терапии
-
КОМПЬЮТЕРНАЯ ТОМОГРАФИЯ В ПЛАНИРОВАНИИ ЛУЧЕВОЙ ТЕРАПИИ
-
ИСТОЧНИКИ ИЗЛУЧЕНИЯ В ТЕРАПИИ
3.1. Сравнительная характеристика ускорителей и изотопных установок
3.2 Линейный ускоритель
3.3 Источники нейтронов
-
ЛУЧЕВАЯ ХИРУРГИЯ.
-
ПРОТОННО-ЛУЧЕВАЯ ТЕРАПИЯ
-
БРАХИТЕРАПИЯ
-
НЕЙТРОННАЯ ТЕРАПИЯ
-
РАДИАЦИОННЫЕ ДОЗЫ В ЛУЧЕВОЙ ТЕРАПИИ
8.1 Экспозиционная и поглощенная доза ионизирующего излучения.
8.2 Распределение дозы при воздействии излучений высокой энергии
-
ПРИМЕРЫ
9.1 Рак предстательной железы
9.2 Комплексная терапия
9.2.1 Нетрадиционное фракционирование дозы
9.2.2. Гипертермия как универсальный радиосенсибилизатор
9.2.3 Химическая радиосенсибилизация злокачественных опухолей
9.2.4
Использование радиопротекторов в лучевой терапии онкологических больных
9.3 Интраоперационная лучевая терапия злокачественных опухолей
9.4 Открытые источники излучения в лечении заболеваниями щитовидной железы и опорно-двигательного аппарата
Историю развития компьютерной томографии и лучевой терапии можно начать с 8 ноября 1895 года, когда в лаборатории Вильгельма Конрада Рентгена было сделано открытие излучения, которое впоследствии было названо рентгеновским излучением. Рентгеновские лучи стали предметом пристального внимания учёных и широкой общественности. Всеобщий интерес был обусловлен уникальным свойством нового излучения – проникать через сравнительно плотное вещество. Стали сразу понятными перспективы рентгеновской диагностики. С 1896 г. началось применение рентгеновских лучей в лечении кожных заболеваний, а чуть позже были предприняты попытки их использования и для лечения злокачественных опухолей. В том же году французский физик Анри Беккерель открыл явление радиоактивности солей урана, а в 1898 г. супругам Кюри удалось выделить новые химические элементы – полоний и радий. В последующие 20 лет были открыты все другие естественные радиоактивные элементы. В 1934 г. супруги Жолио-Кюри впервые получили в лаборатории искусственные радиоактивные изотопы, которые значительно расширили возможность использования ионизирующих излучений как в лучевой диагностике, так и в терапии злокачественных опухолей. Первые попытки применения рентгеновского излучения для лечения злокачественных опухолей основывались на первоначальных сведениях о повреждающем действии этого излучения на ткани. Внедрение в клиническую практику источников высоких энергий, искусственных радиоактивных изотопов существенно расширило возможности лучевого лечения и обеспечило заметное повышение его результативности.
Радиотерапия – использование с лечебной целью излучений естественных и искусственных радиоактивных веществ. Сразу же после открытия радиоактивности было обнаружено ее биологическое действие, а в 1901 французские врачи Э.Бенье и А.Данло применили ее с лечебной целью. В результате дальнейших исследований было установлено, что наиболее чувствительными к излучению радия, также как к рентгеновским лучам, являются молодые, быстрорастущие и размножающиеся клетки. Это привело к мысли использовать радиоактивные излучения для разрушения злокачественных опухолей, состоящих именно из таких клеток. До настоящего времени излучения радиоактивных веществ вместе с рентгенотерапией и хирургическими методами являются наиболее эффективными средствами при лечении злокачественных новообразований.
В зависимости от локализации болезненного процесса и его характера для лечебных воздействий используют
a-, b- и
g-излучения. g-излучение может проникать в ткани на любую глубину и даже проходить через все тело, в то время как
b-частицы могут проникать в ткани только на глубину 20 мм, а
a-частицы – на глубину до 100 микрон.
a-излучение возникает при распаде естественных радиоактивных веществ и используется для лечения или на курортах с природными радиоактивными ваннами или в виде радоновых ванн, которые можно делать и вне курортных условий.
Раньше источниками гамма-излучения служили природные изотопы радий и мезоторий, которые помещали в запаянные платиновые трубочки (иглы) диаметром 1,5 – 3,5 мм и длиной от 1 – 3 см. Такие трубочки располагают на определенное время либо на поверхности тела, либо вводят в полости тела, либо вглубь тканей. Для того чтобы защитить ткани, близко расположенные к препарату, от чрезмерного, порой повреждающего действия, которое имеет место при облучении глубоко расположенных опухолей смешанным излучением радия и мезотория, применяют фильтры, поглощающие
a-, b- излучения и слабое
g-излучение и пропускающие к болезненному очагу только
g-излучение средней энергии.
Действие ионизирующего излучения связано с образованием свободных радикалов в среде микроокружения клеток. Свободные радикалы и оксиданты взаимодействуют с молекулами ДНК, вызывая большое количество разнообразных нарушений ее структуры. Это ведет к дефектам восстановительных функций клетки и, в конце концов, к ее гибели. Во всех случаях применения лучевой терапии в области онкологии радиационное воздействие направлено на повреждение опухоли, сохранение окружающих здоровых тканей.
В клинике наиболее часто используются электроны, которые получают в линейном ускорителе. Пучок электронов применяется для лечения поверхностных опухолей, тогда как рентгеновские и гамма-лучи - для терапии глубоко расположенных. Другие частицы - протоны с положительным зарядом, альфа-частицы, ионы с высоким зарядом (углерод, неон, аргон, кремний), пи-мезоны и нейтроны - используются значительно реже и по особым показаниям.
В технике лучевой терапии используются два основных технических подхода - это телетерапия и брахитерапия. Термин «телетерапия» (tele = дальний) подразумевает, что лечение проводится на расстоянии, с помощью того или иного аппарата. Брахитерапия (brachy = короткий) проводится, когда источник радиации помещается рядом или внутрь облучаемого объекта. При этом источник может оставаться в ткани (как, например, золото-198 или йод-125) или должен быть удален (цезий-137, иридий-192, кобальт-60).
Для лечения доброкачественных и злокачественных новообразований наибольшее применение получил
60Со. По характеру своего излучения он более пригоден для облучения глубоко расположенных очагов; его излучение состоит почти из однородного
g – излучения и b- частиц небольшой энергии (последние легко поглощаются фильтром из никеля). И дает меньше осложнений. Радиоактивный кобальт применяется в аппликаторах (путем наложения на поверхность тела) и в иглах, а также в виде телерадиевой терапии. Последняя состоит в том, что для лечения глубоко расположенных болезненных очагов используют облучение от большого количества кобальта, помещенного в кобальтовую пушку. Кобальтовые «пушки» имеют разную интенсивность излучений, например, установка ГУТ-400 по интенсивности излучения соответствует 400 г радия; она позволяет проводить воздействия на опухоль или другой болезненный очаг, располагающийся на глубине до 15 см от поверхности кожи. С помощью этой установки лечат больных с опухолями легких, пищевода, с раковыми поражениями женских половых органов. Излучение установки ГУТ-20 соответствует излучению 20 г радия. Эта установка используется для лечения поверхностно расположенных опухолей: рака гортани, челюсти, поверхностных лимфотических узлов и других заболеваний.
Искусственно получаемые b-излучающие изотопы используются также и при лечении некоторых кожных и глазных заболеваний. Так радиоактивные изотопы
32Р и 90Sr применяют при лечении доброкачественных опухолей сосудов, экзем, а также раковых поражений кожи. В этом случае пропитанную раствором изотопа и высушенную фильтровальную бумагу помещают в фильтровальный конверт и накладывают на определенное время на пораженные участки кожи; при этом
b-частицы, воздействуя на поверхностно расположенную пораженную ткань, не доходят до здоровых тканей.
Возможность получения нетоксичных, «короткоживущих» радиоактивных изотопов, избирательно поглощающихся определенными тканями, позволяет вводить их внутрь организма. Так радиоактивный
131I, будучи введен в организм (путем приема внутрь), больше всего поглощается щитовидной железой. Эта избирательность и используется при лечении базедовой болезни – заболевания, связанного с повышенной функцией щитовидной железы, а также некоторых форм ее ракового поражения. Избирательное поглощение радиоактивного
32Р костями и костным мозгом, в которых происходит образование красных кровяных телец (эритроцитов), а также лимфоидной тканью при нарушенном образовании в ней красных кровяных телец (лейкоцитов) используется при лечении полицитемии (чрезмерного увеличения эритроцитов) и лейкозов и белокровия. В тех случаях, когда радиоактивное вещество избирательно не поглощается пораженными тканями, его вводят непосредственно в опухоль (внутритканевый метод). Для этой цели, кроме полых игл, используют радиоактивный изотоп золота,
198Au, в виде коллоидного раствора. Этот изотоп быстро распадается (Т=2,7 дн.) и, будучи введен в опухоль, задерживается в ней. Образующиеся при распаде изотопа
b- и g-излучения разрушают опухолевые клетки.
Лучевое лечение злокачественных опухолей может быть радикальным,
паллиативным и симптоматическим. Радикальное лечение предусматривает полное уничтожение, как первичного очага опухоли, так и возможных метастазов. Паллиативное лечение преследует цель задержать рост и развитие опухоли, продлить жизнь больному. Симптоматическое лечение назначается, чтобы снять какие либо тяжелые проявления опухолевого роста, например, сдавливание опухолью прилежащих органов с развитием тяжелых функциональных расстройств.
Существующие способы облучения больного можно разделить на две основные группы:
-
способы дистанционного, или наружного, облучения;
-
способы контактного облучения, при котором источники излучения размещаются либо в полости органа, либо внутри опухолевой ткани (соответственно внутриполостная или внутритканевая лучевая терапия).
Сочетание двух способов облучения или двух видов излучений принято называть сочетанной лучевой терапией.
Для дистанционного облучения в настоящее время в мире применяются гамма-излучение искусственных изотопов, нейтронное излучение, жесткое тормозное излучение. Также применяются ускорители электронов, которые дают тормозное или фотонное излучение с энергией от 4 до 20 МэВ и электроны разной энергии, которую подбирают в зависимости от глубины залегания опухоли и, наконец, пучки ускоренных протонов и других ядерных частиц, которые пока находят ограниченное применение.
Для контактной лучевой терапии, или, как ее все чаще называют, брахитерапии, имеется серия шланговых аппаратов разной конструкции, позволяющих автоматизированным способом размещать источники вблизи опухоли и осуществлять ее прицельное облучение.
Различные опухоли по-разному реагируют на облучение, поскольку имеют разную гистологическую природу, степень дифференцировки клеток, содержат разное количество кислорода и активно пролиферирующих клеток, находящихся в разных стадиях митотического цикла. Именно эти параметры в основном и определяют радиочувствительность опухоли, что, несомненно, принимается в расчет при решении вопроса об индивидуальных показаниях к лучевой терапии.
Успех лучевой терапии зависит от того, насколько точно обеспечивается облучение опухоли и её микроскопических проростков губительными для опухоли дозами, поэтому весьма существенно точно определять местоположение и границы опухоли при помощи клинического обследования с применением оптимальных методов визуализации для конкретного случая её локализации. Наличие нормальных, близлежащих к опухоли органов ограничивает величину радиационной дозы вследствие присущей им специфической радиочувствительности. Если радиационная переносимость органов не будет учитываться при планировании лучевой терапии, то нормальные ткани будут испытывать постоянное повреждающее воздействие.
Обычно локализация опухоли и прилежащих к ней чувствительных органов внутри тела пациента проводится путём рентгеновской съёмки в ортогональных проекциях при введении соответствующих контрастных веществ. План проведения лучевой терапии разрабатывается для плоскости поперечного сечения с применением планирующего компьютера. К сожалению, планарная рентгенография не может визуализировать опухоль. Возникают проблемы и с дозиметрией.
Можно выделить следующие этапы планирования лучевой терапии.
-
Объект облучения должен быть точно обрисован в ходе. Должна быть учтена чувствительность нормальной ткани к предстоящему облучению.
-
Радиолог, лечащий врач и дозиметрист должны разработать несколько конкретных технических вариантов облучения больного, возможно применение компьютерных программ планирования.
-
Должно быть проведено моделирование облучения с учетом диагностических рентгенограмм зоны облучения, формы объекта. Область планируемого воздействия должна быть сфотографирована с обозначением номера, размера и ориентации полей облучения.
-
Должны быть подготовлены устройства для иммобилизации больного и формирования луча.
Лучевая терапия назначается следующим образом.
Врач-радиолог записывает в терапевтической карте больного направление на курс лучевой терапии, в котором отражены указания и разрешение на облучение для техника-радиолога, непосредственно проводящего процедуру. В нем также указывается область воздействия, доза на фракцию, количество доз в день (для режимов гиперфракционирования) или в неделю, энергия пучка, описание поля облучения и общая доза. Часто в направлении даются также указания по наблюдению за состоянием больного (взятие анализов крови, взвешивание).
В практике лучевой терапии широкое применение получили так называемые блоки. Блоками называют предметы, располагаемые между источником излучения и пациентом с целью отграничения поля лучевого воздействия и придания ему формы. Использование блоков помогает максимально избежать облучения нормальной ткани организма. Сначала локализуют область воздействия с помощью рентгенографии. Врач-радиолог помечает на снимке участки, которые нужно исключить из облучения. Снимок становится шаблоном для пенопластового щита, с выемками, которые будут заполнены Cerrobend, легкоплавким сплавом висмута, олова, свинца и кадмия. После охлаждения блоки Cerrobend вынимаются из пенопласта и закрепляются на прозрачном держателе с надписанным именем больного и правилами ориентировки.
Требуемая конфигурация пространственного дозового поля создается путем модификации радиационного пучка. С этой целью применяются
модификаторы пучка. Функция модификаторов луча отличается от функции блоков и заключается в изменении формы поля облучения, исключении нормальной ткани и имеет результатом большую однородность дозы в зоне лечения. К таким устройствам относятся
болюсы, клиновидные и компенсирующие фильтры. Болюс состоит из вещества, эквивалентного ткани организма, и помещается непосредственно на поверхность тела, результатом чего является увеличение дозы в коже и других поверхностных структурах непосредственно под ним. Техника болюса используется также для выравнивания неровностей поверхности тела, тогда доза распределяется более равномерно. Для изготовления болюса используют пластины из пластических полимеров, парафин и влажную марлю. С помощью клиновидного фильтра можно добиться изменения формы распределения дозы в ткани в зависимости от угла клина. Обычно используются фильтры с углами 15, 30, 45 и 60 градусов, но применимы и другие углы. Клиновидные фильтры часто используются при облучении сильно изогнутой поверхности, например, в верхних отделах грудной клетки. Клин ориентируется так, чтобы его наиболее толстая часть располагалась над более тонким слоем ткани. Компенсирующие фильтры из алюминия, воска, меди располагают на пути луча для возмещения неровности контуров ткани.
Чтобы проверить, что лучевая терапия проводится в соответствии с планом и моделью, необходимо сделать рентгенограммы, подтверждающие правильность размера и положения поля облучения, а также позы больного. Такие рентгенограммы называются проходными, или контрольными, снимками, обычно их делают раз в неделю или в момент изменения характеристик поля облучения и блоков.
Проходные снимки отличаются от диагностических рентгенограмм тем, что последние получаются при энергии излучения в киловольтном диапазоне, тогда как первые - на ускорителях с энергией в диапазоне мегавольт. На таких высоких энергиях кости и мягкие ткани поглощают излучение в одинаковой степени и проявляются одинаково.
Облучение больного фракционируют.
Фракционированием называют разделение тотальной дозы облучения на несколько меньших долей. Известно, что желаемый эффект от облучения может быть получен при разделении общей дозы на ежедневные фракции с одновременным снижением токсичности. В терминах клинической медицины это означает, что фракционированная лучевая терапия позволяет достичь более высокого уровня контроля за опухолью и явного снижения токсичности для нормальной ткани по сравнению с одноразовым облучением высокой дозой. Стандартное фракционирование подразумевает 5 облучений в неделю один раз в день по 200 сГр. Общая доза зависит от массы (скрытая, микроскопическая или макроскопическая) и гистологического строения опухоли и чаще определяется эмпирически.
Существует два метода фракционирования - гиперфракционирование и ускоренное. При гиперфракционировании стандартная доза разделяется на меньшие, чем обычные фракции, назначаемые дважды в день; общая продолжительность лечения (в неделях) остается почти прежней. Смысл такого воздействия в том, что: 1) снижается токсичность поздно-реагирующих тканей, которые обычно более чувствительны к размеру фракции; 2) увеличивается общая доза, что повышает вероятность уничтожения опухоли. Общая доза при ускоренном фракционировании немного меньше или равна стандартной, но период лечения короче. Это позволяет подавить возможность восстановления опухоли за время лечения. При ускоренном фракционировании назначают два или больше облучений в день, фракции обычно меньше стандартных.
Облучение часто проводят в условиях гипертермии. Гипертермией называется клиническое применение нагревания опухолевой ткани до температуры выше 42.5оС, которое убивает клетки, усиливая цитотоксические эффекты химио- и радиотерапии. Свойствами гипертермии являются: 1) эффективность против клеточных популяций с гипоксическим, закисленным окружением и истощенными пищевыми ресурсами, 2) активность против клеток в S-фазе пролиферативного цикла, устойчивых к лучевой терапии. Предполагается, что гипертермия воздействует на клеточную мембрану и внутриклеточные структуры, включая компоненты цитоплазмы и ядро. Подведение энергии в ткань достигается микроволновыми, ультразвуковыми и радиочастотными приборами. Применение гипертермии связано с трудностями однородного прогревания крупных или глубоко расположенных опухолей и точной оценки распределения нагрева.
Паллиативный курс лучевой терапии от радикального: целью паллиативной терапии является облегчение симптомов, нарушающих функцию или комфортность или дающих риск развития таковых в обозримом будущем. Режимы паллиативной терапии отличаются увеличенными ежедневными фракциями (> 200 сГр, чаще 250-400 сГр), укороченным общим временем лечения (несколько недель) и сниженной общей дозой (2000-4000 сГр). Увеличение фракционной дозы сопровождается нарастанием риска токсичности для поздно реагирующих тканей, но это уравновешивается укорочением требуемого времени у больных с ограниченными шансами на выживание.
Основным принципом лучевой терапии является создание достаточной дозы в области опухоли для полного подавления ее роста при одновременном щажении окружающих тканей. В основу классификации методов лучевой терапии положено деление их по виду ионизирующего излучения (гамма-терапия, рентгенотерапия, электронная терапия). Целесообразно рассматривать методы лучевой терапии не только в зависимости от вида ионизирующего излучения, но и от способа его подведения к патологическому очагу.
Известна следующая классификация методов лучевой терапии.
-
Дистанционные методы облучения – это такие методы лучевой терапии, при которых источник находится на расстоянии от облучаемой поверхности.
1.1 Дистанционная гамма-терапия
- Статическая: открытыми полями, через решетку, через свинцовый клиновидный фильтр, через свинцовые экранирующие блоки.
- Подвижная: ротационная, маятниковая (секторная), тангенциальная или эксцентричная, ротационно-конвергентная, ротационная с управляемой скоростью.
1.2 Терапия тормозным излучением высокой энергии
- Статическая: открытыми полями, через решетку, через свинцовый клиновидный фильтр, через свинцовые экранирующие блоки.
- Подвижная: ротационная, маятниковая, тангенциальная, ротационная с управляемой скоростью.
1.3 Терапия быстрыми электронами
- Статическая: открытыми полями, через свинцовую решетку, клиновидный фильтр, экранирующие блоки.
- Подвижная: ротационная, маятниковая, тангенциальная.
1.4 Рентгенотерапия
- Статическая: открытыми полями, через свинцовую решетку.
- Подвижная: ротационная, маятниковая, тангенциальная.
-
Контактные методы – это такие методы лучевой терапии, когда источник излучения во время лечения находится в непосредственной близости от опухоли или в ее ткани.
2.1 внутриполостной;
2.2 внутритканевый;
2.3 радиохирургический;
2.4 аппликационный;
2.5 близкофокусная рентгенотерапия;
2.6 метод избирательного накопления изотопов;
-
Сочетанные методы лучевой терапии – сочетание одного из методов дистанционного или контактного облучения.
-
Комбинированные методы лечения злокачественных опухолей
4.1 лучевая терапия и хирургическое лечение;
4.2 лучевая терапия и химиотерапия.
Большой арсенал методов лучевой терапии позволяет индивидуализировать лечение и применять тот или иной способ облучения в зависимости от общего состояния больного, локализации, глубины залегания и распространенности опухолевого процесса.
Компьютерная томография (КТ) внесла важный вклад в установление локализации первичных опухолей. КТ-изображения идеально подходят для целей планирования лучевой терапии, поскольку они формируются в поперечных сечениях и обеспечивают детальную визуализацию опухоли и прилегающих к ней органов, а также оконтуривают тело пациента, что необходимо для дозиметрии. Само собой разумеется, что КТ-исследования должны проводиться в условиях, тождественных тем, при которых должна проводиться лучевая терапия, что необходимо для точной репродукции последующих лечебных процедур.
С включением КТ в планирование терапии был разработан новый метод последовательного планирования, при котором можно избежать предварительного моделирования, а также инвазивных методов, таких, как цистография. При проведении так называемого компьютерного терапевтического сканирования КТ-данные могут быть непосредственно направлены в планирующий компьютер.
Применение компьютерной томографии для планирования лучевой терапии зависит от анатомического расположения опухоли. В
Табл. 1 представлены данные для тех опухолей, для которых применение КТ-метода даёт новую диагностическую информацию, более точно выявляет структуру опухоли и близлежащих к ней нормальных органов, а также осуществляет улучшенную коррекцию неоднородности.
Табл. 1. Области организма, где целесообразно планирование лучевой терапии
| Голова и шея |
Полость рта
Орбита глаза
Околоушная железа |
| Грудная клетка |
Бронхи
Пищевод
Область средостения |
| Абдоминальная область |
Поджелудочная железа
Забрюшинные образования
Почка |
| Область таза |
Мочевой пузырь
Предстательная железа
Прямая кишка |
| Произвольные области |
Саркома мягких тканей |
Ещё большую ценность КТ-метод приобретает при лечении опухолей малого размера, т.е. в тех случаях, когда необходимо проводить облучение с большей точностью, чем при облучении больших объёмов, чтобы исключить риск распространения опухоли на более широкую область.
Используемые в практике лучевой терапии сверхвысоковольтные и изотопные установки, начиная с 1945 претерпели коренные изменения. Вскоре после 1951, когда впервые появились установки с источником
60Со, они начали применяться во многих лечебных центрах. Конструкция этих установок непрерывно совершенствовалась, и в настоящее время создано много различных типов изотопных установок, которые в значительной мере могут заменить используемую ранее терапевтическую аппаратуру.
Успехи в изучении ядерных сил позволили создать установки, генерирующие интенсивные пучки мезонов; в настоящее время получена возможность ускорять частицы до энергий более 30000 Мэв. Эти установки чрезвычайно дороги в строительстве и эксплуатации; некоторые из них, созданные вначале для решения задач ядерной физики, стали ценными в лучевой терапии.
Табл. 2. Установки для получения излучений и частиц большой энергии, применяющиеся в лучевой терапии.
| Тип установки |
Генерируемые частицы |
Метод ускорения и область использования |
| Бетатрон |
Электроны |
Электроны ускоряются на круговой орбите при помощи
изменяющегося магнитного поля и удерживаются на орбите возрастающим
магнитным полем. Установки, дающие электроны с энергией от 15 до 25 Мэв,
используются в лучевой терапии. |
| Синхротрон |
Электроны, протоны |
Частицы удерживаются на круговой орбите с помощью нарастающего магнитного поля и ускоряются при помощи ВЧ - резонансного промежутка. Синхротроны, ускоряющие электроны до энергий 25…70 Мэв, используются в лучевой терапии.
Линейный ускоритель
Электроны
Электроны ускоряются на строго прямолинейном пути с помощью движущейся ВЧ радиоволны. Установки, дающие электроны с энергией от 2 до 45 Мэв,
используются в лучевой терапии. |
| Электростатический генератор |
Электрон, протоны, a-частицы, дейтроны
|
Высокое напряжение поддерживается путем перенесения электрических зарядов от потенциала земли до высокого конечного напряжения с помощью быстро движущейся изоляционной ленты. Генераторы, дающие электроны с энергией 2…4 Мэв,
используются в лучевой терапии. |
| Резонансный трансформатор |
Электроны |
Высокое напряжение получается вследствие использования настроенного контура, состоящего из емкости и индуктивности. Установки, дающие электроны с энергией 2 Мэв,
используются в лучевой терапии. |
| Изотопные установки |
g-Лучи |
60Со и 137Со обычно используются
как источник g-лучей в лучевой терапии. |
Изотопные установки также включены в Табл. 1. В этих установках источником излучения является радиоактивный изотоп, испускающий проникающие
g-лучи.
В ускорителях для получения пучка частиц с энергиями, превышающими несколько Мэв, используют принцип многократного ускорения. Реальный прогресс в ускорении частиц наступил с применением высокочастотных генераторов, которые позволили осуществлять ускорение частиц переменным электрическим током. В хорошо откачанной ускорительной камере последовательно вдоль ее оси располагаются цилиндрические полые электроды. Нечетные электроды (1, 3, 5 и т.д.) соединены с одним полюсом высокочастотного генератора, четные электроды - с другим. Размеры электродов, зазоры между ними и частота высокочастотного генератора подобраны таким образом, что частицы на любом участке между соседними электродами оказываются в ускоряющем электрическом поле. Например, частица, получив ускорение на участке между электродами 1 и 2, пройдя электрод 2, попадет на участок, на котором к этому времени также действует ускоряющее поле в направление электрода 3. Для того чтобы частицы во всех зазорах оказывались в режиме ускорения, они должны
двигаться в такт с изменением электрического поля. Поэтому при постоянном напряжении и частоте высокочастотного генератора длины следующих друг за другом цилиндрических электродов (т.е. участков на которых ускорение не происходит) относятся как квадратные корни последовательного ряда чисел. Требование к последовательному увеличению длины цилиндрических электродов связано с сохранением синфазного ускорения частиц по мере увеличения их кинетической энергии. Чем меньше масса частицы, тем длиннее должна быть ускорительная камера и больше частота высокочастотного генератора. Линейные укорители нашли практическое применение в медицине после того, как были разработаны достаточно мощные генераторы сантиметрового диапазона (магнетроны и клистроны ).
Линейные ускорители можно использовать для ускорения заряженных частиц всех видов. Особые трудности до сих пор возникали при ускорении электронов, так как для этого требовалась очень длинная ускорительная камера и релятивистский прирост массы сказывается уже при относительно малых энергиях. Поэтому в современных линейных ускорителях отказались от конструкций с цилиндрическими электродами и перешли к резонансным ускорителям с бегущей волной. При достаточно высокой частоте генератора, а, следовательно, малой длине волны (l?5r, где r-внутренний диаметр ускорительной камеры) в ускорительной камере возбуждается высокочастотное электрическое поле с бегущей волной. Вектор электрического поля направлен параллельно оси камеры, а магнитные силовые линии образуют концентрические окружности. Для уменьшения фазовой скорости бегущей волны ускорительная камера разделяется дисками с концентрическими отверстиями. Пространство между двумя соседними дисками представляет собой объемный резонатор. Таким образом, фазовая скорость снижается в зависимости от емкости и индуктивности резонаторов. Фазовая скорость бегущей волны везде должна быть равной скорости электронов, которые все время должны находиться вблизи бегущей волны и двигаться в такт с ней.
В ускорителях электронов, во избежание рассеяния частиц, в процессе работы должен поддерживаться высокий вакуум. Хотя конструкция электронов уже обеспечивает фокусировку пучка, в большинстве современных ускорителей устанавливают дополнительные фокусирующие устройства типа электромагнитных линз, используемых в электронной оптике. В большинстве электронных ускорителей, предназначенных для медицинских целей, генерирование тормозного рентгеновского излучение осуществляется путем торможения потока ускоренных частиц о мишень из платины или другого тяжелого материала. Пучок ускоренных электронов можно вывести из ускорительной камеры через тонкое окно. Для лучевой терапии можно уже сегодня изготавливать линейные ускорители с энергией десятки Мэв сравнительно небольших размеров. Линейные ускорители генерируют поток частиц высокой плотности и поэтому позволяют получить значительные мощности дозы. Линейные ускорители в отличие от генератора Ван-де-Граафа генерируют импульсное излучение с большой скважностью, так как современные высокочастотные генераторы, питающие ускоритель, могут работать только в импульсном режиме
В настоящее время для лучевой терапии используются линейные ускорители на энергии 4, 6, 8, 15, и 45 Мэв. Наибольшее распространение получил линейный ускоритель на 4 Мэв. Благодаря применению принципа бегущей волны ускоритель может быть создан столь небольшим, что головка для излучения может быть выполнена подвижной и для возможности ротационного облучения. Установки на 8 и 15 Мэв (есть ускорители на энергию 45 МэВ) имеют такую большую длину ускорительных камер, что они уже не могут выполняться подвижными.
В конце пути ускорения электронный пучок с помощью магнитной оптики отклоняется на 90о и потом сбрасывается на мишень. Благодаря этому получается конический пучок рентгеновского излучения, который проходит перпендикулярно вниз. Магнитное отклонение теперь можно повернуть на угол 120о по отношению к оси камеры ускорителя, так что пучок рентгеновского излучения может быть наклонен от 15о к вертикали до 15о к горизонтали. Для ограничения поля служит вставная диафрагма из вольфрамового сплава толщиной 8 см , которая обеспечивает установку прямоугольного поля облучения ступенями в пределах от 4 см до 20 см. В этом ускорители также предусмотрена возможность облучения качающимся полем путем комбинации вращения пучка рентгеновского излучения вокруг горизонтальной оси с одновременным горизонтальным и вертикальным перемещением стола, на котором располагается пациент.
Аппарат предусматривал возможность облучения качающимся полем. По отношению к горизонтально расположенной камере ускорителя пучок электронов с помощью магнитной оптики сначала поворачивался на угол 45о вверх, а потом на угол 135о вниз, так что обеспечивалось вертикальное направление центрального пучка излучения. Одновременно со вторым отклонением достигалась дефокусировка электронного пучка, необходимая для облучения полей большого размера. Благодаря этому возможно облучение качающимся полем, во время которого общая магнитная отклоняющая система вращается вокруг оси камеры ускорителя. Этот ускоритель предусматривает облучение только электронами и находится в стадии испытаний.
Нейтронные источники из калифорния-252 успешно применяются для нейтронной терапии до сих пор. (Подробнее см. курс лекций «Ядерная индустрия». Другой класс ИИИ базируется на атомных реакторах, являющихся источников нейтронов и гамма-излучений (как постоянных, так и импульсных) Ядерные реакторы достаточно широко используются для терапии злокачественных новообразований. Создан широкий набор тест-систем и получены радиобиологические характеристики плотноионизирующих, комбинированных, смешанных радиационных воздействий, осуществлено формирование, исследование и внедрение в практику новых полей и пучков гамма-нейтронного и нейтронного излучений для медико-биологических целей. Усовершенствованы расчетно-теоретические модели для описания радиобиологических эффектов и планирования лучевой терапии. В России импульсное нейтронное излучение (в том числе со сверхвысокими мощностями доз) для медицинских целях добывается на реакторе БАРС-6, а метод нейтрон-захватной терапии осуществляют на реакторе БР-10, дающем быстрые нейтроны.
Источник эпитепловых нейтронов
В последние годы в онкологии стала распространяться идея использования пучка питепловых (0,5 эВ<En<10 кэВ) нейтронов для реализации методов нейтронозахватной терапии рака в клинике. Основными элементами установки для подобной терапии является ускоритель протонов до энергии 3 МэВ и нейтроногенерирующая мишень ускорительного источника нейтронов.
Для ускорительных источников эпитепловых нейтронов, рассматриваются четыре реакции:
7Li(p,n), 9Be(p,n), 9Be(d,n) и 13C(d,n). В
Табл. 3 приведены основные характеристики этих реакций и свойства мишени.
Табл. 3. Ядерные реакции – источники тепловых нейтронов.
| Реакция |
Энергия заряж. частиц, МэВ |
Выход нейтронов при 10 мА, c-1 |
Средняя энергия нейтронов в 0 град., МэВ |
Макс. энергия нейтронов, МэВ |
Температура плавления, °С |
Коэфф. теплопроводности, Вт/(м K) |
| 7Li(p,n) |
2,5 |
8,9·1012 |
0,55 |
0,786 |
181 |
71 |
| 1,915 |
2,9·1011 |
0,04 |
0,113 |
| 9Be(p,n) |
4,0 |
10·1012 |
1,06 |
2,12 |
1287 |
201 |
| 9Be(d,n) |
1,5 |
2,1·1012 |
2,01 |
5,81 |
| 13C(d,n) |
1,5 |
1,8·1012 |
1,08 |
6,77 |
3550 |
230 |
Наилучшей реакцией генерации эпитепловых нейтронов является бомбардирование протонов по литию: поток нейтронов большой и энергетический спектр сравнительно мягкий. Однако механические, химические и тепловые свойства лития плохие. Альтернативные мишени из бериллия-9 и углерода-13 позволяют преодолеть трудности в изготовлении мишени и ее охлаждении, однако для достижения сравнимого потока нейтронов из мишени требуются более мощные пучки. Более того, замедление генерируемых из этих мишеней более энергетичных нейтронов до эпитепловых энергий требует использования более протяженных модераторов, а потому еще более мощных пучков, компенсирующих уменьшение потока эпитепловых нейтронов в области терапии. Поэтому самой перспективной считается литиевая мишень.
При выборе мишени необходимо учитывать такие факторы как:
-
Для нейтронозахватной терапии идеален энергетический спектр, в котором отсутствуют нейтроны с энергией ниже 0,5 эВ и выше 10 кэВ. Важно и отсутствие
g-излучения;
-
Реакция 7Li(p,n)7Be является наилучшей для генерации эпитепловых нейтронов, однако литий имеет низкую температуру плавления, плохую теплопроводность и высокую химическую активность;
-
Каждый акт рождения нейтрона в результате реакции 7Li(p,n)7Be сопровождается появлением радиоактивного ядра изотопа бериллия. Генерация нейтронов в течение нескольких часов уже может приводить к наведенной активности, препятствующей простому обращению с мишенью;
-
Неупругое рассеяние протонов на ядрах лития приводит к излучению
g-квантов энергией 0,477 МэВ. В случае, если протоны полностью поглощаются в слое лития, поток
g-квантов сравним с потоком нейтронов и даже может его превосходить. Существенного понижения этого паразитного потока
g-квантов можно достичь созданием литиевого слоя такой толщины, чтобы при прохождении этого слоя энергия протонов уменьшалась только до 1,882 МэВ – энергии порога реакции генерации нейтронов. Дальнейшее поглощение протонов должно осуществляться в веществе (например, в фольфраме), в котором упругое рассеяние протонов не приводит к излучению
g-квантов;
-
При имплантации 2 МэВ-ных протонов в твердые тела поверхностный слой может деформироваться вплоть до образования блистеров и отслаивания чешуек. Появление развитой поверхности мишени может не только приводить к усиленному испарению лития из-за уменьшения теплопроводности, но и вообще делать мишень непригодной. Оцениваемая доза по блистерингу достигается за время, сравнимое со временем планируемого облучения (около 10 мин);
-
Чистый литий более эффективен для генерации нейтронов по сравнению с гидридом, оксидом, нитридом или фторидом лития, обладает более высоким коэффициентом теплопроводности, однако имеет несравненно меньшую температуру плавления и потому требует эффективного теплосъема при желательно более низкой температуре литиевого слоя. Возможно использование мишени с жидким литиевым слоем, однако существенное испарение лития повлечет за собой не только снижение высоковольтной электрической прочности из-за поступления паров лития, но и распространение возникающего радиоактивного изотопа бериллия по всей установке.
Оптимальной мишенью для сооружаемого источника нейтронов является неподвижная мишень с интенсивным жидкостным охлаждением.
Реакция 7Li(p,n)7Be является пороговой и характеризуется быстрым ростом сечения реакции вблизи порога. Это свойство позволяет рассматривать дополнительную возможность работы в припороговом режиме, когда энергия протонов превышает на 30 – 40 кэВ порог реакции 1,882 МэВ. В этом случае кинематически коллимированный вперед нейтронный пучок со средней энергией 30 кэВ может быть прямо использован для нейтронозахватной терапии. Поэтому для генерации нейтронов следует использовать реакцию
7Li(p,n)7Be при энергии протонного пучка 1,915 или 2,5 МэВ.
Чистый литий более эффективен для генерации нейтронов по сравнению с гидридом, оксидом, нитридом или фторидом лития и обладает более высоким коэффициентом теплопроводности, однако имеет несравненно меньшую температуру плавления и потому требует эффективного теплосъема при желательно более низкой температуре литиевого слоя. Возможно использование мишени с жидким литиевым слоем, однако существенное испарение лития повлечет за собой не только снижение высоковольтной электрической прочности из-за поступления паров лития, но и распространение возникающего радиоактивного изотопа бериллия по всей установке.
Каждый акт рождения нейтрона в результате реакции 7Li(p,n)7Be сопровождается появлением радиоактивного ядра изотопа бериллия. Изотоп бериллия
7Be в результате захвата орбитального электрона с периодом полураспада в 53,6 дня превращается в стабильный изотоп лития
7Li. В 89,7 % случаев распад идет без излучения, а в 10,3 % — с испусканием
g-кванта энергией 0,477 МэВ. Поскольку изотоп 7Be локализован только в литиевом слое приемника пучка, то в тот момент, когда наведенная активность
7Be приближается к 109 Бк, генерация нейтронов прекращается, установка выключается, приемник пучка снимается с установки, помещается в свинцовый ящик и переносится в удаленный отстойник.
Мишень представляет собой тонкий металлический диск диаметром 10 см, на который со стороны протонного пучка напыляется тонкий слой чистого твердого лития, а обратная сторона диска интенсивно охлаждается турбулентным потоком воды. Такая простая и легко заменяемая мишень позволяет решить проблему блистеринга и наведенной активности. Для обеспечения однородного температурного поля на поверхности мишени желательно иметь однородный протонный пучок диаметром 10 см, что может быть осуществлено разверткой протонного пучка меньшего размера по всей мишени. Развертка с частотой более 100 Гц является приемлемой для того, чтобы максимальная температура слоя не превышала температуру плавления лития и флуктуации температуры были незначительны.
Гамма- нож. При использовании источников гамма-излучения высокой интенсивности приходится говорить не столько о терапии, сколько о хирургии, поскольку в данном случае опухоль уничтожается целиком. В качестве «гамма-ножа» выступают мощные кобальтовые пушки, источником излучения в которых является радионуклид
60Со, получаемый облучением нейтронами мишени на высокопоточном атомном реакторе.
В настоящее время для радиохирургического лечения злокачественных опухолей созданы методы дозиметрического планирования, решены радиационно-гигиенические задачи применения источников разных конструктивных форм. Разработаны методические аспекты применения контактной терапии источниками
52Cf и 60Co в различных сочетаниях с дистанционным облучением, радиосенсибилизирующими средствами. Оценены непосредственные, ближайшие и отдаленные результаты контактной терапии у больных раком слизистой оболочки полости рта и ротоглотки. Определены перспективы дальнейшего исследования по использованию контактных методов лучевой терапии различными источниками излучения.
Протонная лучевая терапия (ПЛТ) во всем мире признана одним из перспективных направлений лучевого лечения. В отличие от других используемых в дистанционной лучевой терапии видов излучения пучки протонов обеспечивают уникальное распределение дозы по глубине. Максимум дозы сосредоточен в конце пробега (то есть в облучаемом патологическом очаге – мишени), а нагрузка на поверхности тела и по пути к мишени минимальна. Лучевая нагрузка за мишенью (по ходу пучка) полностью отсутствует. Место размещения и протяженность дозного максимума зависит от энергии протонов и легко регулируется. И, наконец, почти полностью отсутствует рассеяние излучения («полутени») в теле больного - хорошо сколлимированный на входе в тело пучок практически не изменяет размеров поперечного сечения по всей длине пробега частиц. Характерное дозное распределение, применяемое при облучении новообразований глаза. Обращает на себя внимание уже упоминавшееся полное отсутствие лучевой нагрузки за мишенью и высокий краевой градиент дозы. Он необходим при облучении новообразований этой локализации, но, вообще говоря, легко регулируется в широких пределах.
Эти особенности протонного излучения позволяют облучать патологический очаг, в том числе, малых размеров (офтальмоонкология, радионейрохирургия), в точном соответствии с его формой, минимально повреждая при этом окружающие здоровые ткани. Эта уникальная особенность протонного излучения дает возможность повысить до оптимального уровня дозу во всем объеме мишени и, в то же время, практически полностью избежать постлучевых осложнений, чему на всех этапах развития лучевой терапии придавалось первостепенное значение. Кроме того, появилась не имеющая аналогов в дистанционной лучевой терапии возможность облучать новообразования, расположенные практически вплотную к критическим радиочувстительным органам и структурам, полностью исключая облучение последних.
Органосохраняющим методом лечения локализованных форм рака предстательной железы, органов полости рта, ротоглотки, носоглотки, гортани, новообразований органов грудной клетки и брюшной полости является интерстициальная лучевая терапия (брахитерапия), позволяющая производить имплантацию в опухоль радиоактивных микроисточников, которые вызывают гибель злокачественных клеток.
При лечении в опухоль вводятся десятки микроисточников, стоимость которых составляет значительную долю стоимости всей операции. Для лечения огромной армии больных во всем мире, страдающих в настоящее время вышеперечисленными онкологическими заболеваниями, требуется новые медицинские методики и значительные количества недорогих микроисточников. Решить эту проблему можно только путем снижения стоимости лечения за счет снабжения клиник достаточным количеством источников и внедрения новых методик лечения.
В онкологии наибольшее распространение получили микроисточники на базе изотопов йода-125 и палладия-103 в виде игл или растворимых полимерных нитей. Радионуклиды должны быть тщательно очищены, поскольку радиоактивные примеси отрицательно влияют на качество лечения онкологических заболеваний. Брахитерапия требует проведения сложных вычислений дозных полей, создаваемых имплантированными источниками внутри опухоли, с привлечением трехмерных моделей расчета переноса энергии.
В настоящее время ведутся фундаментальные и прикладные исследования биологического действия нейтронов разных энергий с целью получения новых знаний о природе биологического действия нейтронов, повышения эффективности нейтронной терапии, уточнения норм радиационной безопасности. В числе используемых биологических объектов - микроорганизмы (клетки бактерий и дрожжей с различным репарационным генотипом), клетки млекопитающих и человека, лабораторные животные (мыши, крысы, кролики, собаки, поросята).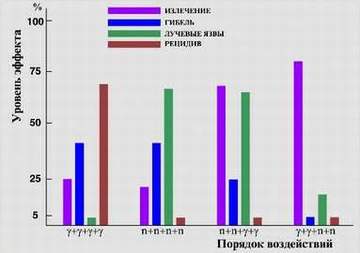 Изучаемые тест-эффекты - образование генных и структурных мутаций, противоопухолевая эффективность на модельных опухолях, влияние радиомодифицирующих факторов, относительная биологическая эффективность на клеточном и организменном уровнях, репарация повреждений ДНК, генетический контроль радиочувствительности, адаптивный ответ, эффекты мощности дозы нейтронов малых доз и комбинированных воздействий различных излучений. Установлено, что различное сочетание гамма и нейтронной компонент приводит к существенному изменению эффекта воздействия на опухоли и нормальные ткани.
Изучаемые тест-эффекты - образование генных и структурных мутаций, противоопухолевая эффективность на модельных опухолях, влияние радиомодифицирующих факторов, относительная биологическая эффективность на клеточном и организменном уровнях, репарация повреждений ДНК, генетический контроль радиочувствительности, адаптивный ответ, эффекты мощности дозы нейтронов малых доз и комбинированных воздействий различных излучений. Установлено, что различное сочетание гамма и нейтронной компонент приводит к существенному изменению эффекта воздействия на опухоли и нормальные ткани.
Рис.1 Биологическое действие смешанных излучений.
На импульсном реакторе БАРС-6 (ГНЦ РФ ФЭИ) проводятся исследования особенностей биологического действия импульсных радиационных воздействий (нейтронного, смешанного гамма-нейтронного, гамма) в диапазоне мощностей доз от 10-2 Гр/с до 107 Гр/с). Накоплен опыт дистанционной нейтронной терапии опухолей на реакторе БР-10. Получено обоснование терапевтического применения реакторных нейтронов. Начинается клинический этап нейтрон-захватной терапии в России.
В практике клинических условий вводится понятие входной экспозиционной дозы, под которой понимают дозу излучений, измеренную в воздухе на определенном расстоянии между источником
излучения и поверхностью тела. Она может быть пересчитана в поглощенную дозу, т.е. в энергию, поглощенную некоторым объемом биологической ткани. Особый клинический интерес представляют оценки локальной дозы, т.е. дозы в некоторой точке исследуемого биологического объекта. Поглощенная доза приповерхностного слоя тела, а измеренная на некотором расстоянии от поверхности – глубинной.
Величина поверхностной дозы определяется не только входной дозой, но также и рассеянным излучением, которое возникает в тканях. Величина поверхностной дозы зависит от природы излучений, их энергии и объема облучаемого участка тела. Объем облучаемого участка определяется величиной поля облучения и толщиной данного участка тела.
Для определения эффективной дозы в том или ином участке тела важно знать данные о пространственной, объемной и интегральной дозах, т. е. о суммарной величине энергии, поглощенной в определенном объеме тела. Терапевтическая эффективность излучений определяется в первую очередь очаговой дозой, т.е. эффективной дозой в патологическом очаге. Если ее сопоставить с дозой в облученном объеме тела, то можно получить величину
относительной очаговой пространственной дозы.
Распределение дозы с глубиной для фотонного (например, рентгеновского) и корпускулярного (например, протонов) существенно различно (хотя бы потому, что для протонов можно ввести понятие максимального пробега, а для фотонного излучения нельзя). При движении от поверхности вглубь тела, доза от рентгеновского излучения падает, и под относительной глубинной дозой понимают отношение глубинной дозы к поверхностной, а доза от корпускулярного излучения, наоборот, возрастает (до глубин, близких к пробегу, затем она падает), под относительной глубинной дозой понимают отношение глубинной дозы к максимальной. Сопоставление этих двух величин относительных доз вполне возможно, так как в случае применения рентгеновых лучей поверхностная доза почти совпадает с максимальной.
Особенности действия излучений высокой энергии в тканях определяются специфическим распределением по глубине тела поглощенной дозы от конкретного вида излучений. За исключением нейтронов, все другие виды корпускулярных излучений, (протоны, дейтроны и др.), имеют следующие особенности распределения дозы: относительная доза увеличивается с глубинной; ростом энергии излучения поверхностная доз уменьшается, а объемная доза увеличивается.
Для лучевой терапии имеет большое значение факт роста дозы по мере погружения вглубь тела. Дело в том, что в этом случае патологический очаг, находящийся на большой глубине, может получить большую дозу излучений без одновременного увеличения поверхностной дозы. В то время при воздействии рентгеновых лучей максимум дозы лежит близко к поверхности тела и резко падает, в подлежащих тканях при применении излучении высокой энергии максимум дозы передвигается в глубину тканей; при этом отмечается значительно меньшая потеря величины дозы с глубиной.
Например, в случае воздействия излучений высокой энергии и быстрых электронов (по сравнению с воздействием равных доз обычных рентгеновых лучей 200 кв.) в ткани на глубине 8 см отмечается чрезвычайно выгодное для лучевой терапии распределение доз. В частности, при использовании современных установок для телегамматерапии достигается значительное увеличение глубинных доз и уменьшение неблагоприятного действия излучений на кожу. Применение излучений высокой энергии по сравнению с телегамматерапией дает еще более выгодное распределение глубинных доз. Корпускулярные излучения высокой энергии особенно пригодны для лечения глубоко расположенных опухолей, так как в глубоких слоях тканей при воздействии этого вида излучений создается чрезвычайно высокая относительная глубинная доза. В противоположность этому быстрые электроны с энергией от 10 до 20 Мэв в связи с особенностями распределения дозы применяются для лучевой терапии при поверхностной локализации опухолей. Быстрое падение дозы в глубине тела, которое наблюдается при воздействии электронов, положительно сказывается на относительной пространственной дозе в очаге и приводит лишь к очень незначительному облучению подлежащих здоровых тканей.
При воздействии излучений высокой энергии вследствие незначительной эффективной поверхностной дозы на входном поле нет необходимости ограничивать облучения, чтобы щадить кожу, как это приходится делать в случае применения обычных рентгеновых лучей: при воздействии излучений очень высокой энергии кожа на входном поле не подвергается переоблучению. Это же явление при облучении электронами наблюдается при диапазоне энергий от 3 до 20 Мэв. Причиной щажения кожи на входном поле является увеличение длины пробега ионизирующих частиц при возрастании их энергии. Например, если вторичные электроны с относительно малой энергией в 200 кэв вследствие своего небольшого пробега оказывают воздействие практически в тех участках, где происходит первичное поглощение квантов, то вторичные электроны высокой энергии имеют большую длину пробега. Такие вторичные электроны высокой энергии вызывают ионизацию не на месте первичного поглощения излучений, а вдоль всей траектории, причем плотность ионизации особенно велика в конце траектории. В связи с тем, что электроны движутся главным образом прямолинейно вдоль пучка излучений, место воздействия излучений перемещается в более глубокие слои тканей, соответственно длине пробега, определяемой величиной энергии электронов.
Такая особенность действия излучения высокой энергии, называемая эффектом лавины или переходным эффектом, приводит к перемещению максимума дозы в глубь тканей и поэтому величина дозы от поверхности в глубь ткани не падает, а повышается. Так, например, максимум дозы у излучений от радиоактивного кобальта в тканях, эквивалентных по плотности воде, находится примерно на глубине 3 - 5 мм, а для излучений и электронов с энергией 15 Мэв - на глубине около 30 мм. Величина и характер возрастания дозы при этом зависят от природы излучений, размера поля и расстояния источник - кожа.
Наряду с значением величины очаговой, глубинной и поверхностной доз, определяющими облучение кожи, при проведении лучевой терапии особый интерес представляет доза излучения, поглощенного всем телом, т. е. объемная или интегральная доза, и сопоставление ее с величиной очаговой дозы. Значения интегральных доз для отдельных видов излучений и пространственное распределение глубинных доз можно оценить при учете распределения интенсивности излучений по изодозам. При сопоставлении значений интегральных доз разных видов излучений оказывается, что обычная рентгенотерапия непригодна для лечения глубоко расположенных опухолей, так как при увеличении глубины расположения опухоли интегральная доза резко возрастает и, следовательно, здоровые ткани при этом подвергаются интенсивному облучению. Для лечения опухолей, расположенных как поверхностно, так и на большой глубине, учитывая небольшие интегральные дозы, с успехом можно применять дистанционную гамматерапию. В противоположность этому рентгеновские излучения высоких энергий особенно пригодны для лечения глубоко расположенных опухолей, так как при таком лечении интегральная доза относительно низкая, поверхностная доза на входном поле очень мала, сохраняется узкий рабочий пучок излучения и не наблюдается существенного рассеяния излучений. В костной ткани при определенных уровнях энергий не происходит повышенного поглощения излучении.
Совершенно иная картина наблюдается при воздействии электронов. При проведении глубокой лучевой терапии при помощи электронов интегральная доза очень быстро возрастает, что особенно заметно при сопоставлении с воздействием тормозного излучения такой же энергии. Это возрастание интегральной дозы связано с тем, что при применении электронов с энергией до 30 Мэв, необходимых для осуществления глубокой лучевой терапии, доза позади очага снижается недостаточно круто. К тому же в результате рассеяния излучений происходит «паразитическое» облучение здоровых тканей, расположенных вокруг поля облучения. Оно относительно больше при использовании малых полей.
С точки зрения величины интегральной дозы лучевая терапия быстрыми электронами целесообразна при поверхностно расположенных опухолях. По минимальным значениям интегральных доз электронное излучение имеет преимущества по сравнению с рентгеновыми лучами при расположении опухоли на глубине не более 6 см под поверхностью кожи, а оптимальная энергия электронов составляет не более 20 Мэв. Чрезвычайно низкая интегральная доза при облучении электронами небольшой энергии поверхностно расположенных опухолей обусловлена резко ограниченной глубиной проникновения электронов с такой энергией. Поэтому паразитического облучения здоровых тканей, расположенных за очагом, практически не наблюдается.
Рак предстательной железы, поражающий, как правило, мужчин старше 50 лет, - одно из самых распространенных онкологических заболеваний, а по темпам прироста оно опережает все другие локализации.
В современной медицине при лечении локализованного рака простаты (1-я и 2-я стадии) стандартом считается радикальная простатэктомия, с которой сравниваются все остальные методы. Но это сложная хирургическая операция с неопределенным исходом, сопровождающаяся большой кровопотерей и требующая высокой квалификации хирурга, длительного наркоза, больших сроков госпитализации. Пациенты, перенесшие простатэктомию, в 40% случаев страдают впоследствии от недержания мочи и практически всегда - от импотенции. Все эти факторы сдерживают распространение хирургического лечения рака простаты.
Другой метод, применяемый для лечения этого онкологического заболевания, - дистанционная лучевая терапия. К ее преимуществам можно отнести лучшую, чем при простатэктомии, переносимость; меньший риск развития импотенции и недержания мочи; возможность амбулаторного лечения. Но в то же время при лучевой терапии поражаются окружающие органы и ткани, прежде всего мочевой пузырь и прямая кишка, развиваются такие неприятные осложнения, как лучевой цистит и проктит, лучевые язвы. Дистанционную лучевую терапию приходится проводить в течение 7-8 недель, чтобы уменьшить повреждения здоровых тканей.
Многолетней мечтой онкологов и урологов было создание малоинвазивного и в то же время эффективного метода лечения рака простаты, который бы прицельно поражал только затронутые опухолью ткани. Еще в начале уходящего века были проведены первые эксперименты по брахитерапии. Брахитерапия (БТ) - внутритканевая лучевая терапия предстательной железы путем имплантации закрытого источника гамма-излучения (например,
125I) непосредственно в пораженную опухолью предстательную железу. Имплантация источника проводится в опухоли, обладающие низкой или средней радиочувствительностью.
Метод может использоваться для лечения как основного заболевания (например, рака простаты), так и для лечения остаточных явлений после иссечения первичной опухоли. Брахитерапия может быть проведена пациентам, которым не показано радикальное хирургическое лечение, а также дистанционная лучевая терапия из-за патологических процессов в кишечнике.
Подобно многим недавно появившимся технологиям, брахитерапия впервые была представлена много лет назад: вначале 1910 ее проводили с использованием радиевых иголок и начиная с 1930 - с радиоактивным золотом. Возрождение БТ простаты началось в 1970 с развитием технологии открытой имплантации зерен
125I. Технология появилась как альтернатива радикальной простатэктомии, но затем была забыта до конца 1980 х годов. Причиной неудач явилось то, что зерна йода располагались мануально при открытой технологии, в результате чего не достигалось оптимального распределения дозы в предстательной железе, и наряду с зонами с чрезмерной активности, оставались и холодные очаги. Тогда не было возможности контролировать распределение дозы радиоактивного излучения в предстательной железе, да и риск для медицинского персонала при работе с открытыми источниками радиации был слишком высок. Наблюдение за пациентами после ретропубикальной технологии имплантации показывает болезненность и травматичность в результате наличия очагов повышенной активности. Техника открытого хирургического вмешательства также значительно повышает травматичность процедуры имплантации зерен. Поэтому этот метод был на некоторое время забыт.
Перелом произошел в начале 80-х годов, когда была предложена технология трансректального доступа под контролем ультразвука с использованием специального шаблона, который позволяет точно доставлять радиоактивные зерна с помощью игл в нужное место предстательной железы.
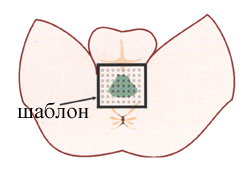 Рис.2. Положение источников излучения при терапии рака простаты.
Рис.2. Положение источников излучения при терапии рака простаты.
Подобная техника применяется для визуализации точного положения радиоактивных источников в простате, ее можно осуществить подкожно под ультразвуковым контролем. Процедура включает две стадии. Первая - использование ультразвука для определения объема простаты и получения информации с координат шаблона для расчета количества и положения радиоактивных источников, необходимого для достижения равномерной дозы радиации в предстательной железе. На второй стадии источники излучения вводятся в простату и использованием шаблонной сетки. Иглы вводятся через кожу промежности закрытым способом. Планирование возможно на основании данных компьютерной томографии. Общая доза радиации в простате и ее распределение рассчитываются компьютерной программой.
Лечение методом брахитерапии включает две стадии. Сначала с помощью трансректального ультразвукового исследования определяют объем простаты и получают информацию с координат шаблона для расчета количества, активности и расположения радиоактивных источников, необходимых для создания равномерной дозы в предстательной железе. Затем, с помощью шаблонной сетки, иглы с размещенными в них источниками вводят в простату закрытым способом. Доза облучения простаты и ее распределение в тканях рассчитывается с помощью компьютерной программы.
Наибольшее распространение для брахитерапии нашел радионуклид йода,
125I. 125I распадается путем электронного захвата с испусканием характеристического излучения с энергиями: 27,2 кэВ (39,8%); 31,0 кэВ (14%); 27,47 кэВ (74,1%); 31,71кэВ (4,30%); 30,94 кэВ (7,20%) и гамма-излучения с энергией 35,94 кэВ (6,67%). Период полураспада
125I составляет 60,1 суток. Источник на основе йода-125 представляет собой или иглы или гибкие нити, рассасывающиеся в организме. Наиболее известен закрытый источник «I-125 Rapid Strand» представляет собой капсулы с титановой оболочкой, фиксированные на рассасывающейся нити, содержащие
125I, осажденный на серебряном стержне. Поглощенная мощность дозы в воздухе на расстоянии 1 м от одного источника активностью 1 МБк равна 0,035 мкГр/ч. Активность, содержащаяся в одной капсуле размером 0,8 х 4,5 мм, лежит в диапазоне от 0,7·107 до 3·107 Бк (от 0,2 до 0,8 мКи); мощность поглощенной дозы в воздухе на расстоянии 1 м от одного источника составляет от 0,1 до 8 мкГр/ч. Слой половинного ослабления излучения равен 0,025 мм свинца, а мягких тканей организма - 2 см. Излучение от источника, введенного в предстательную железу, ослабляется примерно в 6-8 раз. «I-125 Rapid Strand» поставляется стерильным в защитном пенале из нержавеющей стали, который обеспечивает практически полное (>99,9%) поглощение низкоэнергетического характеристического и гамма-излучения. Материал нити (викрил) после имплантации рассасывается в тканях, капсулы остаются в месте имплантации.
Радионуклид палладия получают на установке для радиохимического выделения
103Pd из мишеней металлического серебра, облученных на ускорителе (Более подробно вопросы производства радионуклидов рассмотрены в Курсе«Ядерная индустрия».
Процедура брахитерапии является одноразовой и проводится в два этапа. На первом этапе происходят определение объема простаты и получение информации для расчета количества и положения радиоактивных зерен. При этом используется ультразвуковой аппарат с трансректальным датчиком. Главная цель - достижение равномерной дозы радиации в предстательной железе. На втором этапе источники радиоактивного излучения в виде зерен, содержащих йод-125 и фиксированных на нити, вводятся закрытым способом в простату с помощью специальных игл. Обычно их бывает 60-90 в зависимости от объема предстательной железы. Уролог заранее определяет этот объем и размер опухоли. Исходя из его расчетов медицинский физик устанавливает, сколько необходимо микроисточников и где их лучше расположить в пораженном органе, чтобы добиться его равномерного облучения.
Процедура имплантации проводится в операционной под общим наркозом и длится чуть более часа. Она хорошо переносится даже пожилыми людьми с тяжелыми сопутствующими заболеваниями, проходит практически без осложнений и дает высокий процент выздоровлений и в случаях, когда процесс уже сильно распространен. Это особенно важно при рецидивном раке предстательной железы. После удаления игл зерна остаются в простате и обеспечивают нужный уровень радиоактивного излучения в течение нескольких недель и месяцев.
125I имеет период полураспада 60 дней, обычно рекомендованная минимальная периферическая доза составляет 140-160 Гр. Поскольку зерна доставляются непосредственно в простату, концентрация излучения внутри опухоли в 2-3 раза выше, чем при дистанционной лучевой терапии, где используются более низкие дозы из-за опасения повредить здоровые ткани. Источник герметичен, поэтому облучения медицинского персонала практически не происходит, и нет необходимости в специальном обустройстве палат, канализации и других повышенных мерах радиационной безопасности. Пациент может выписаться из клиники на следующий день после имплантации и вскоре приступить к своей привычной деятельности. Брахитерапия пользуется успехом благодаря высокому проценту выздоровления. По данным, поступающим из американских клиник, 10-летняя выживаемость пациентов после брахитерапии составляет 79% - практически столько же, сколько и у здоровых пациентов данного возраста. Если по эффективности брахитерапия сравнима с радикальной простатэктомией, то по количеству осложнений имеет неоспоримые преимущества (недержание мочи развивается не более чем в 4% случаев, а импотенция - не более чем в 15%). Кроме того, пациент после брахитерапии выписывается из клиники в тот же или на следующий день и возвращается к нормальной жизнедеятельности в течение нескольких дней.
Немаловажна и экономическая сторона. Брахитерапия обходится примерно вдвое дешевле радикальной простатэктомии. А если принять во внимание то, что первая дает значительно меньшее число осложнений, которые тоже надо лечить, то разница в стоимости становится еще более ощутимой.
Для пациентов пределы доз облучения не устанавливаются, но используется принцип оптимизации, основанный на получении необходимого терапевтического эффекта при минимально возможных уровнях облучения в процессе планирования и проведения радиационного вмешательства. В целях обеспечения безопасности других лиц на протяжении периода нахождения в стационаре пациенту не рекомендуется покидать пределы палаты. Безопасность других лиц, которые могут находиться вблизи пациента с имплантированным источником ионизирующего излучения (другие пациенты, персонал нерадиологических отделений, родственники и др.), регламентируется в соответствии с НРБ-99 установлением мощности дозы на расстоянии 1 м от пациента, которому с терапевтической целью введены радиофармацевтические препараты. Мощность дозы на расстоянии 1 м не должна превышать при выписке пациента из радиологического отделения 3 мкЗв/ч. Указанная мощность дозы гарантирует с большим запасом непревышение дозы в 1 мЗв, которую могут получить родственники или другие лица за полный распад нуклида в теле пациента. После выписки из стационара пациенту рекомендуется пользоваться отдельной постелью, а также ограничить близкое общение с детьми (держать на коленях) и беременными женщинами в течение полугода с момента имплантации источника. При сохранении половой функции после выписки из стационара первые шесть месяцев необходимо использовать презервативы. Для проведения индивидуального дозиметрического контроля рекомендуются термолюминесцентные дозиметры с детектором из LiF.
Существует два вида брахитерапии.
Постоянные имплантанты.
Этот вид является самой распространенной формой БТ. При постоянной имплантации источники остаются в простате и обеспечивают радиацию в течение нескольких недель или месяцев. Йод
125I имеет период полураспада 60 дней и обычно рекомендованная минимальная периферическая доза составляет 160 Гр на объем, который включает капсулу простаты плюс 2 или 3 мм запаса. Это значит, что 80 Гр доставляется в первые 60 дней и остальное в уменьшающейся дозе в течение следующих 4-6 месяцев.
Палладий 103Рd имеет период полураспада 17 дней, что в 3-4 раза короче, чем
125I. Палладий используется в некоторых центрах для лечения опухолей с более высокой степенью злокачественности, которые растут быстрее, чем опухоли с низкой степенью. Вследствие более высокого уровня излучения была сделана коррекция периферической дозы для палладия 115 Гр вместо 160 Гр.
125I имеет энергию 27-35 Кэв, 103Pd 20-23 Кэв. Низкая энергия означает, что имеется низкий уровень проникновения в ткани что соответствует обратному закону квадратов о дозе уменьшающейся на 50% от минимальной периферической дозы. Это обеспечивает значительное преимущество с точки зрения уменьшения дозы в прилегающих критических структурах таких как прямая кишка и нейроваскулярные пучки.
Преимущество постоянной имплантации заключается в том, что лечение проводится однократно и может выполняться амбулаторно или с последующим однодневным пребыванием в стационаре. Недостатком является необходимость учитывать период жизни радиоактивного источника. Однако радиационная энергия источников такая низкая, что облучение других людей незначительно и требует чрезвычайно простых методов защиты.
Временные имплантанты.
Источники, содержащиеся в иглах или трубках вводятся в простату и удаляются после окончания лечения. Существует два способа такого введения:
-
Продолжительное воздействие низкими дозами имплантируемого источника (LDR). Устройство заряжается ирридиевой проволокой низкой активности которая доставляет радиацию в необходимый участок.
-
Воздействие высокими дозами имплантанта. (HDR). Этот способ заключается в использовании источников высокой активности для доставки радиации в простату. Из-за больших доз радиации лечение плохо переносится, поэтому необходимо фракционное лечение с использованием техники HDR. Обычно для лечения с 4-6 фракций нужно или разделить пространство на 2 или 3 d или применять две отдельные аппликации. Поскольку источник остается в простате на протяжении всего времени имплантации и воздействует на промежность, он не может оставаться там более 1-2 дней.
Показания для постоянной имплантации 125I и 103Pd и радикальной простатэктомии почти одни и те же. Однако пациентам, которым не подходит простатэктомия, может быть показана брахитерапия. При высоком риске локализованного рака простаты, приходится комбинировать наружную лучевую терапию с имплантацией радиоактивных зерен. Метод брахитерапии является альтернативным по отношению к радикальной простатэктомии или дистанционной лучевой терапии, или в сочетании с последней. Преимуществом метода является снижение вероятности возможных осложнений, в том числе недержания мочи, осложнений со стороны прямой кишки, а также сохранение потенции.
Но брахитерапия под ультразвуковым контролем имеет ряд противопоказаний: большие размеры предстательной железы, конкременты в ней, распространение злокачественного процесса на семенные пузырьки и т.д. Такие ограничения устраняются, когда операция проводится под контролем спиральной компьютерной томографии. Брахитерапия под контролем компьютерного томографа позволяет, кроме всего прочего, проводить биопсию семенных пузырьков. Это очень важно для правильной постановки диагноза и точного определения распространенности рака предстательной железы, без чего невозможно его успешное лечение.
Ведущим способом лечения в онкологии является комплексный и комбинированный методы, суть которых заключается в сочетании как местного воздействия на опухоль (лучевой, хирургический), так и общего (химио, гормоно, иммунотерапии).
Комбинированная терапия - сочетание лучевого и хирургического методов лечения, предполагающую радикальную операцию и адекватное по дозировке и объему облучение. Комплексная терапия - сочетание всех трех основных компонентов лечения: лучевого, хирургического и лекарственного.
Существуют различные подходы к реализации комплексной терапии рака.
Использование ионизирующих излучений в клинике основано на различиях в радиочувствительности опухоли и нормальных тканей, именуемых радиотерапевтическим интервалом. При воздействии ионизирующих излучений на биологические объекты возникают альтернативные процессы: повреждение и восстановление. При облучении в культуре ткани степень лучевого повреждения и восстановления опухоли и нормальных тканей равнозначны. Но ситуация резко меняется при облучении опухоли в организме больного. Первичное повреждение остается равнозначным, но не равнозначно восстановление. Нормальные ткани за счет стойких нейрогуморальных связей с организмом-носителем восстанавливают лучевые повреждения быстрее и полнее, чем опухоль. Используя эти различия и управляя ими, можно добиться тотального разрушения опухоли, сохранив нормальные ткани.
Один из способов управления радиочувствительностью основан на фракционировании дозы облучения, поскольку при адекватно подобранном варианте дробления дозы без каких-либо дополнительных затрат можно добиться существенного повышения повреждения опухоли с одновременной защитой окружающих тканей. В России в случаях радикального лечения традиционным считается фракционирование по 1,8-2 Гр один раз в день, 5 раз в неделю до суммарных доз, которые определяются морфологической структурой опухоли и толерантностью нормальных тканей, расположенных в зоне облучения (обычно в пределах 60-70 Гр).
В принципе, с точки зрения противоопухолевого эффекта более эффективен непрерывный курс облучения. Однако это не всегда возможно из-за развития острых лучевых реакций. Поэтому предложено после подведения определенной дозы (критической по развитию острых лучевых реакций) делать перерыв в лечении для реоксигенации и восстановления нормальных тканей. Неблагоприятным моментом перерыва является опасность репопуляции сохранивших жизнеспособность опухолевых клеток. После различной продолжительности отставания во фракционированном лучевом лечении выживающие клоногенные клетки развивают настолько высокие темпы репопуляции, что для их компенсации каждый дополнительный день лечения требует прибавки 0,6 Гр. Тем не менее, при расщепленном курсе улучшается переносимость лечения, особенно в случаях, когда острые лучевые реакции препятствуют проведению непрерывного курса. Величина интервала составляет 10-14 дней, т.к. репопуляция выживших клоновых клеток начинается в начале 3-й недели.
Помимо традиционного фракционирования существуют и нетрадиционные режимы:
Гипофракционирование - применение более крупных, по сравнению с классическим режимом, фракций (4-5 Гр), общее количество фракций уменьшено;
Гиперфракционирование - применение небольших, по сравнению с "классическими", разовых очаговых доз (1-1,2 Гр), подведенных несколько раз в день. Общее число фракций увеличено;
Непрерывное ускоренное гиперфракционирование - фракции более приближены к классическим (1,5-2 Гр), но подводятся несколько раз в день, что позволяет уменьшить общее время лечения;
Динамическое фракционирование: режим дробления дозы, в котором подведение укрупненных фракций чередуется с классическим фракционированием либо подведением доз меньше 2 Гр несколько раз в день и т.д.
В основу построения всех схем нетрадиционного фракционирования положена информация о различиях в скорости и полноте восстановления лучевых повреждений в различных опухолях и нормальных тканях и степень их реоксигенации. Так, опухоли, характеризующиеся быстрым темпом роста, выраженной радиочувствительностью, требуют подведения укрупненных разовых доз. Примером может служить метод лечения больных мелкоклеточным раком легкого.
Гепертермия заключается в нагреве опухоли в процессе облучения до температуры 42оС и даже выше, поскольку существует определенная зависимость между температурой нагрева опухоли и ее реакцией на лучевое воздействие. Метод перспективен в лучевом или химиолучевом лечении больных с местно-распространенными опухолями различных локализации (рак молочной железы, рак предстательной железы, рак поджелудочной железы, саркома и др.). Так, в случае рака поджелудочной железы частота полной и частичной регрессии опухоли при температуре 42оС и выше составила 60%, а при температуре ниже 42оС - 22%. Основными факторами, определяющими эффективность гипертермической лучевой терапии, является температура в опухоли, объем и глубина залегания последней.
Ионизирующее излучение, химические соединения и другие факторы внешней среды приводят к мобилизации всех ресурсов клетки, к инициации целой цепи процессов, происходящих на разных уровнях клеточной организации. Отдельные звенья этой цепи, реализующиеся на молекулярном уровне, хорошо изучены, как, например, некоторые типы повреждения ДНК и отдельные этапы ее репарации. Однако не исследована связь событий, происходящих на молекулярном уровне с гибелью клетки и роль в гибели клетки каждого отдельного звена. Не ясно, что нужно в клетке изменить, на какие структуры и процессы подействовать, чтобы добиться изменения эффекта в необходимом направлении. Ситуация осложняется при переходе к популяциям клеток в опухолях. Помимо клеточных факторов, в этом случае необходимо учитывать наличие системы, которая может реагировать как единое целое, и в то же время характеризоваться высокой степенью гетерогенности. Опухолям присущи определенные закономерности роста и развития, причем сами закономерности или их кинетические параметры варьируют. Для опухолей также важно выяснить, на какие процессы или структуры в клетках или на какие субпопуляции клеток опухолей и как нужно воздействовать, чтобы можно было управлять их реакцией.
Для модификации лучевой реакции клеток и опухолей используют химические соединения, отличающиеся по структуре и механизму действия, исходя из следующих предпосылок: свободно-радикальные процессы играют большую роль в лучевом поражении, и изменение их активности должно сопровождаться изменением реакции клеток; ингибиторы синтеза ДНК модифицируют реакцию клеток на облучение, что связано с подавлением синтеза ДНК; определенные нарушения структуры ДНК могут сопровождаться увеличением гибели клеток.
Известно, что
-
химические соединения разных классов, увеличивающие радиационное повреждение ДНК, приводят к повышению эффективности радиотерапии опухолей;
-
для направленного изменения реакции клеток необходимо учитывать временные параметры действия химиотерапевтических препаратов. Одно и то же химическое соединение в зависимости от времени контакта с клетками при использовании в одной и той же концентрации может вызывать уменьшение и увеличение степени лучевой реакции клеток. Для направленного изменения реакции опухолей необходимо строгое соблюдение соотношения доз облучения, доз препарата, временных параметров действия препарата;
-
имеются индивидуальные различия в реакции опухолей одного гистогенеза и размера у разных животных на облучение и воздействие химических соединений. Эти различия могут быть обусловлены колебаниями доли непролиферирующих клеток в отдельных опухолях.
-
непролиферирующие и покоящиеся клетки опухолей менее чувствительны к сенсибилизирующему воздействию химических соединений, чем пролиферирующие. Покоящиеся клетки могут выживать после облучения и становиться источником рецидивов.
Многие способы повышения радиочувствительности опухолей основаны на использовании кислородного эффекта. Поскольку основным свойством кислорода, позволяющим усиливать радиационное поражение, является сродство к электрону, логичен был поиск других соединений - акцепторов электронов. Этот поиск привел к обнаружению обширного класса химических соединений, обладающих способностью захватывать электрон, - электроноакцепторных соединений (ЭАС). В отличие от кислорода, ЭАС, помимо быстрого механизма сенсибилизации, способны к т.н. медленной сенсибилизации, для осуществления которой необходимо длительное время: за счет связывания сульфгидрильных групп (SН) восстановителей и избирательного действия на гипоксические клетки, независимо от облучения. Препаратами, усиливающими степень повреждения опухоли являются мизонидазол и метронидазол (МЗ).
Существенным моментом в действии ЭАС оказалась высокая степень зависимости эффекта от длительности контакта и концентрации препарата в среде. Степень сенсибилизирующего эффекта зависит от объема опухолевого поражения и возрастает по мере его увеличения. Спад интереса к ЭАС связан с их высокой токсичностью, хотя в большинстве исследований коэффициент усиления достигал 1,5.
Известно, что радиочувствительность клеток в определенной мере зависит от фазы клеточного цикла. На этом основании возникла идея синхронизации. Синхронизирующим агентом является 5-фтор-урацил. Под его воздействием клетки, находящиеся в разных фазах клеточного цикла, тормозятся перед вступлением в фазу S и вместе вступают в нее и вместе достигают фазы митоза, наиболее чувствительной к облучению. Опухолевые клетки в фазе синтеза ДНК, резистентные к облучению, проявляют чувствительность в 5-фторурацилу. Поэтому при сочетанном применении противоопухолевого лекарства и ионизирующего излучения происходит усиление повреждения опухоли.
По мере изучения препаратов платины выяснилось многообразие механизмов их действия: они не только оказывают непосредственное цитостатические влияние на опухолевую клетку, но и ингибируют репарацию сублетальных и потенциально летальных постлучевых повреждений и тем самым повышают степень резорбции опухоли, причем для этого необходимы дозы, значительно меньшие, чем терапевтические. Помимо этого производные платины снижают количество межклеточного метионина. В результате повышается связывание фтордезоксиуридина монофосфата с тимидилатсинтетазой. Нельзя не принимать в расчет и синергизма всех трех воздействий. В схему химиолучевого лечения включили в качестве лекарственного компонента оба препарата.
Несмотря на огромные объемы облучения и дополнительное введение противоопухолевых лекарств лечение в запланированном объеме перенесли более, чем 90% больных. Эффект достигнут за счет применения нетрадиционного фракционирования дозы, а также и за счет широкого спектра протекторов (лазерное воздействие, лапрот, антиоксидантный комплекс, иммунофан и т.д.). Учитывая тяжелый контингент больных, следует отметить неожиданно высокий процент непосредственного излечения, который в равной степени относится к опухолям с различным морфологическим строением.
Основными требованиями к использованию радиопротекторов являются улучшение результатов лечения при сохранении функциональных способностей жизненно-важных органов и тканей.
Поиск способов расширения терапевтического интервала, т.е. различий в радиочувствительности опухоли и попадающих в зону лучевого воздействия нормальных тканей, идет в течение многих лет. Изучены множество агентов, изменяющих радиочувствительность клеток как в сторону увеличения (радиосенсибилизаторы), так и уменьшения (радиопротекторы). Однако в лучевой терапии необходимы агенты обеспечивающие избирательность действия. Поэтому практическое применение получили лишь несколько радиомодификаторов. К их числу относится использование гипоксической гипоксии, т.е. гипоксии, создаваемой при дыхании газовыми смесями, содержащими пониженное по сравнению с воздухом количество кислорода.
Предпосылкой к избирательности эффекта служит наличие в опухоли острогипоксических клеток, которые возникают вследствие характерного для опухолей кратковременного - на минуты и десятки минут - прекращения кровотока в части сосудов, вызванного повышенным давлением в растущем новообразовании. Клетки, оказавшиеся в зоне прекращения кровотока именно в момент сеанса лучевой терапии резко увеличивают радиорезистентность опухоли. Для большинства тканей защитный эффект смесей, содержащих 9-10% кислорода, даже в условиях фракционированного воздействия позволяет увеличивать разовую и курсовую дозу примерно в 1,2 раза.
Разрабан метод гипоксирадиотерапии, позволяющий подвести к опухоли при лучевом лечении дозу большую, чем при конвенциальной лучевой терапии. Хорошие результаты дает применение жесткой гипоксической газовой смеси, содержащей 9% кислорода и 91% азота (ГГС-9). Сравнение радиопротекторных свойств антиоксидантов и ГГС-9 при лучевом лечении больных раком желудка при одних и тех же условиях облучения показывает, что антиоксиданты в значительно меньшей степени защищают окружающую опухоль нормальную ткань.
Сейчас меняется взгляд на природу и механизмы радиационной гибели клеток, что связано, в первую очередь, с изучением
генетических механизмов апоптотической формы клеточной гибели. Обнаружено существование в клетке своеобразной сигнальной системы, которая выявляет наличие в генетических структурах повреждений, может останавливать продвижение клеток по циклу для реализации восстановительных процессов возникших повреждений, и дает команду для запуска процессов, ведущих клетку к апоптотической гибели в случае неуспеха в реализации восстановительных процессов или при исчерпании энергетических ресурсов клетки. Работа этой сигнальной системы зависит от скоординированной деятельности группы генов, центральное место среди которых занимает ген р53. Хотя большинство типов опухолевых клеток погибает после воздействия ионизирующей радиации по механизму пролиферативной гибели, есть корреляция между индивидуальной радиочувствительностью опухолевых клеток, и показателями, характеризующими выраженность процессов, имеющих отношение к апоптозу. Индивидуальная радиочувствительность опухолевых клеток и радиочувствительность определенных форм опухолей зависят от состояния сигнальной системы клетки, принимающей решения о форме ее реакции на возникающие повреждения. Такие факторы как активность репарационных ферментов, определяющих восстановление радиационных повреждений, выраженность гипоксии, наличие эндогенных радиопротекторов и другие компоненты представляет собой отдельные элементы сложной и работающей под генетическим контролем системы. Изучение деятельности этой системы может привести к разработке новых методов управления радиочувствительностью и резистентностью злокачественных опухолей и нормальных тканей и к совершенствованию методов лучевой и комбинированной терапии онкологических больных.
При комплексном лечении больных злокачественными лимфомами используются различные варианты чередующегося химиолучевого лечения, отличающихся по объему, режиму фракционирования и суммарным дозам облучения. Хорошие результаты получены при лечении больных неходжкинской лимфомой с использованием нетрадиционного фракционирования дозы облучения. Перспективными оказались методики, сочетающие крупнопольное и бустерное облучение в сфере лечения рефрактерных форм лимфом. Важно, что при этом достигается стойкий местный контроль очагов рецидива при облучении их в интервалах между циклами полихимиотерапии в режиме ускоренного гиперфракционирования.
Новое направление в радиоонкологии базируется на использовании высоких однократных доз ионизирующего излучения во время оперативного вмешательства. Существует методика комбинированного лечения с интраоперационной лучевой терапией (ИОЛТ) больных раком желудка, ободочной и прямой кишок, молочной железы, яичников и тела матки, остеогенной саркомой. В данном варианте лучевой терапии используется широкий диапазон однократных доз от 10 - 20 до 60 Гр при облучении костного реплантанта. Предварительные результаты продемонстрировали повышение эффективности лечения при наиболее неблагоприятных, местно-распространенных формах опухолей.
Препарат 131I весьма высокой активности для полного насыщения злокачественных клеток у больных раком щитовидной железы. Продемонстрирована также высокая эффективность радиойодтерапии при лечении больных с метастазами рака в легкие, кости. Новый радиофармпрепарат самарий-153-оксабифор дает хороший терапевтический эффект при метастатических поражениях скелета.
 Изучаемые тест-эффекты - образование генных и структурных мутаций, противоопухолевая эффективность на модельных опухолях, влияние радиомодифицирующих факторов, относительная биологическая эффективность на клеточном и организменном уровнях, репарация повреждений ДНК, генетический контроль радиочувствительности, адаптивный ответ, эффекты мощности дозы нейтронов малых доз и комбинированных воздействий различных излучений. Установлено, что различное сочетание гамма и нейтронной компонент приводит к существенному изменению эффекта воздействия на опухоли и нормальные ткани.
Изучаемые тест-эффекты - образование генных и структурных мутаций, противоопухолевая эффективность на модельных опухолях, влияние радиомодифицирующих факторов, относительная биологическая эффективность на клеточном и организменном уровнях, репарация повреждений ДНК, генетический контроль радиочувствительности, адаптивный ответ, эффекты мощности дозы нейтронов малых доз и комбинированных воздействий различных излучений. Установлено, что различное сочетание гамма и нейтронной компонент приводит к существенному изменению эффекта воздействия на опухоли и нормальные ткани. Рис.2. Положение источников излучения при терапии рака простаты.
Рис.2. Положение источников излучения при терапии рака простаты.