Профессор
И.Н.Бекман
Курс лекций ЯДЕРНАЯ МЕДИЦИНА
Лекция 4. ЯДЕРНАЯ ДИАГНОСТИКА В КЛИНИКЕ
Содержание.
- ОТДЕЛЕНИЕ РАДИОНУКЛИДНОЙ ДИАГНОСТИКИ
- КЛИНИЧЕСКИЕ МЕТОДЫ РАДИОНУКЛИДНОЙ ДИАГНОСТИКИ
2. 1.
Радионуклидные методы оценки функционального состояния органа
2. 2. Радионуклидная визуализация
2.3. Радиоиммунологический анализ
-
РАДИОНУКЛИДНАЯ ДИАГНОСТИКА НЕКОТОРЫХ ЗАБОЛЕВАНИЙ
3.1 Радионуклидная диагностика заболеваний щитовидной железы
3.2. Изучение состояния печени
3.3 Радионуклидная диагностика патологии легких
3.4 Радионуклидная диагностика заболевания почек и мочевыводящих путей
3.5 Радионуклидная диагностика в кардиологии
3.6 Радионуклидная диагностика в онкологии
3.6.1
Статическая сцинтиграфия (сканирование) с туморотропным РФП
3.6.2 Метод радиофосфорной диагностики меланомы кожи
3.6.3 Диагностика костных заболеваний
3.7
Динамическая гамма-сцинтиграфия селезенки при хирургической патологии
3.8 Диагностика болезней костей
Отделение радионуклидной диагностики - функциональное подразделение лечебно-диагностического учреждения, в котором используют радионуклиды.
Помещения отделения включают: хранилище РФП, фасовочную; комнату для получения из генератора короткоживущих радионуклидов, генераторную; моечную для инструментов, посуды, контейнеров, процедурную, кабинеты для радиометрии, радиографии,
g-камеры, сканера и для определения активности биологических сред (исследований in vitro), санпропускник для персонала, оборудованный душевой установкой и сигнализаторами радиоактивной загрязненности поверхности кожи, одежды, обуви.
Контроль за радиационной обстановкой в отделении и дозиметрический контроль за уровнями облучения медицинского персонала осуществляется ежедневно (допустимые дозы: 0,017 мкэв/день; 0,1 мкэв/неделю; 5 мкэв/год)
Средства защиты персонала делят на:
-
стационарные защитные устройства - это неподвижные сооружения: утолщенные стены, экранированные свинцом двери, металлические фасовочные камеры, хранилища с оборудованными сейфами из свинца для хранения контейнеров, которые обеспечивают защиту от излучения всех лиц, находящихся в данном и смежных помещениях;
-
передвижные защитные устройства: контейнеры из свинца, в которых хранят РФП, переносные защитные экраны, дистанционный инструментарий;
-
индивидуальные средства защиты: респираторы, резиновые перчатки, фартуки, нарукавники, очки.
Всех обследуемых пациентов делят на 3 категории:
к 1 категории (АД) относят пациентов, которым радионуклидное исследование назначено по жизненным показаниям (для выяснения локализации и характера опухоли, в том числе у детей);
ко 2 категории (БД) принадлежат неонкологические больные, которым необходимо уточнить диагноз заболевания или выбрать оптимальный способ лечения;
к 3 категории (ВД) причисляют людей, которым радионуклидные исследования назначается в порядке проверочного обследования.
Радиодиагностические исследования не производятся женщинам категорий БД и ВД в период установленной или возможной беременности, а также детям до 16 лет категории ВД. Женщинам в период кормления грудью могут проводиться радиодиагностические исследования при условии, что на время пребывания радионуклида в организме матери кормление грудью прекращается.
Исследования, проводимые in vitro - безопасны для пациента.
В 1 группу входят исследования, проводимые in vivo: РФП вводят внутривенно, перорально , ингаляционно.
Во 2 группу входят методы, проводимые in vitro, без введения больному радиоактивного вещества (радиоиммунный анализ - РИА). Их особенностью является возможность определения искомого вещества в пробирке с помощью диагностических тест-наборов, содержащих радиоактивную метку. Для анализа достаточно 1-5 мл крови иди другой биологической среды. Лучевая нагрузка на пациента при этом отсутствует.
Радионуклидные методы 1 группы можно разделить на три вида:
-
методы оценки функционального состояния без получения изображения изучаемого органа (радиометрия, радиография);
-
морфологические методы изучения структурно-топографических особенностей органов и систем (сканирование, сцинтиграфия) с последовательным получением изображения изучаемого органа в каждой его точке на бумаге (сканограмма) или одновременным изображением всех точек на дисплее ЭВМ статическая сцинтиграмма);
-
морфо-функциональные методы, обеспечивающие одновременно визуализацию внутренних органов и регистрацию их функциональной деятельности (динамическая сцинтиграфия). Современные
g-камеры и эмиссионный томограф позволяют визуализировать такие быстрые процессы, как прохождение РФП по камерам сердца, сосудам головного мозга, легких, почек за счет
Радиометрия - измерение уровня накопления РФП в исследуемом органе или биологических пробах в разные временные интервалы (например, по показателям поглощения
131I щитовидной железой оценивается ее функциональное состояние). Результаты измерений выражаются в процентах или условных единицах импульс в минуту (имп/мин)
Радиография - непрерывная регистрация прохождения введенной активности (выраженной в скорости счета импульсов) на движущейся бумажной ленте самопишущего прибора. Результаты измерений изображаются в виде кривых - радиограмм, которые подвергаются анализу и сравниваются с нормой.
Методики радиографии в зависимости от цели исследования имеют соответствующие названия:
-
радиокардиография (РКГ) - регистрация скорости прохождения РФП через камеры сердца с целью определения минутного объема и других параметров сердечной деятельности;
-
радиогепатография - регистрация скорости прохождения РФП через паренхиму печени для оценки поглотительной и выделительной функции гепатоцитов и клеток РЭС;
-
радиоренография - регистрация скорости прохождения РФП через почки с целью диагностики нарушений секреторной и выделительной функции каждой почки раздельно;
-
радиоцеребрография (РЦГ) - регистрация скорости прохождения РФП через полушария мозга для определения нарушений мозгового кровотока
-
радиопульмонография - регистрация скорости прохождения РФП через легкие, а также через их отдельные сегменты с целью определения параметров регионарной функции каждого легкого и сегментов.
Методы изучения распределения в органах и тканях введенного РФП с получением их изображения на бумаге, фотографиях (поляроидах) или экране дисплея носят названия сканирование и сцинтиграфия. При этом врач получает объективные данные о величине, форме, топографии органа и наличие в нем диффузных или очаговых патологических изменений. Статическое сканирование (выполняется на сканере) и статическая сцинтиграфия (выполняется на
g-камере) проводятся с РФП, которые после введения в организм стабильно фиксируются в органах и тканях. Сцинтиграфия имеет преимущество в быстроте выполнения исследования (не более затрачивается 30-40 мин.), а также в возможности компьютерной обработки изображения (сглаживание, цифровая и цветовая обработка и др.) Динамическая сцинтиграфия проводится на
g-камерах, оснащенных ЭВМ, и позволяет одновременно получить информацию об анатомо-топографическом, морфологическом состоянии органа и его функции. С помощью видеопульта в ЭВМ вводятся условия исследования: ф. и. о. больного, название методики, РФП, число и последовательность кадров, время исследования и другие данные, которые нельзя менять во время проведения процедуры исследования. Получаемая информация от органов больного воспроизводится на экране дисплея ЭВМ в виде серии кадров ?-топограмм, отражающих динамику прохождения РФП через исследуемый орган. На суммарной
g-топограмме врач выбирает зону интереса - область исследуемого органа (проток, желчный пузырь, лоханку, мочеточник), с которых ЭВМ строит кривые (гистограммы), отражающие его функцию. Показатели динамической сцинтиграфии бывают качественные и количественные. Под качественными показателями понимают визуальный анализ серии
g-топограмм. При этом оцениваются положение органа, его форма, размеры, четкость контуров, наличие очаговых изменений. Количественная обработка сводится к построению компьютером кривых позволяющих оценить временные показатели функции того или иного органа. К данному типу исследований относят серийную гепатобилисцинтиграфию, радионуклидную ангиографию, динамическую сцинтиграфию почек, легких.
Принципиальной основой методик радиоиммунохимических исследований in vitro (РИА) является конкурентное связывание исследуемых и идентичных, искусственно меченых изотопом веществ или соединений со специфическими связывающими системами (антитела, транспортные белки плазмы или рецепторные белки). РИА позволяет производить количественное определение в биологических субстратах (кровь, моча, лимфа и др.) любого химического вещества, к которому могут быть получены специфические антитела. Преимущества РИА по сравнению с биологическими и биохимическими методами:
-
большая чувствительность, позволяющая определять малые количества вещества (10-10 г/мл)
-
высокая специфичность, обусловленная принципом иммунологических (антиген-антитело) реакций;
-
точность и воспроизводимость метода;
-
простота выполнения анализа и значительная пропускная способность, дающая возможность проводить без особых трудностей большого количества проб (400-800 в неделю);
-
отсутствие лучевой нагрузки на больного.
При осуществлении РИА используются следующие реагенты:
-
выделенный из биологического материала немеченный антиген,
-
меченный 125I антиген с высокой удельной активностью (0,5 ГБк)
-
антисыворотка, содержащая специфические антитела к исследуемому антигену. Для этого выпускаются стандартные тест-наборы, содержащие все необходимые компоненты.
В настоящее время промышленность обеспечивает выпуск радиоиммунологических диагностикумов, в том числе – тест-систем для диагностики вирусных гепатитов.
Процесс РИА проводят при постоянном количестве антисыворотки и меченого антигена. Причем концентрация антисыворотки всегда должна быть в дефиците, а меченого антигена - в избытке, что обеспечивает конкуренцию между определяемым и меченым антигенами за ограниченное число мест связывания на антителах.
В наибольшей мере радиотестирование in vitro используется для определения концентрации следующих биологически активных веществ:
-
гормонов (для диагностики сахарного диабета, патологии гипофизарно-надпочечниковой и тиреоидной систем, выявления причин бесплодия у женщин, развития плода).
-
опухолевых антигенов, например, раковоэмбрионального антигена для ранней диагностики злокачественных опухолей и контроля за эффективностью их лечения
-
иммуноглобулинов и специфических реагентов (в диагностике аллергических заболеваний, вирусных инфекций, в том числе СПИДа).
Диагностика основана на физиологических предпосылках избирательного поглощения изотопов
131I, 132I, 99Тс щитовидной железой.
Функциональные методы исследования щитовидной железы сводятся к оценке интратиреоидного (1) этапа йодного обмена основана на регистрации через определенные промежутки времени накопления в щитовидной железе
131I. Измеренные значения накопления сравнивают с величиной введенной активности посредством определения стандартного времени регистрации 10000 импульсов от индикаторной дозы
131I (обычно 20-50 сек) и рассчитывают количество поглощения препарата тиреоидной тканью в процентах. Показания к исследованию: наличие диффузного или узлового поражения щитовидной железы, подозрение на дистиреоз, необходимость контроля за эффективностью лечения или оперативного вмешательства на щитовидной железе. Противопоказания общие (см. 1. 3) и блокада щитовидной железы йодсодержащими препаратами. Подготовка к исследованию заключается в длительной отмене (4 - 2 месяца) медикаментов, содержащих йод или бром, в ближайшие к исследованию 1 - 2 недели прекращается прием антитиреоидных, гормональных препаратов, антибиотиков, салицилатов, транквилизаторов
Пациент натощак принимает перорально 0,074 мБк натрий йодида - 131, разведенные в 30-50 мл воды. Измерения после приема препарата на одноканальной сцинтилляционной установке с фокусного расстояния 15 см от детектора.
Табл.1. Показатели поглощения 131I щитовидной железой (%):
| Сроки исследования |
Функциональное состояние щитовидной железы |
| |
Эутиреоз |
Гиперфункция |
Гипофункция |
Блокада |
| 2 часа |
10-20 |
35-55 |
6-10 |
2-5 |
| 4 часа |
15-30 |
40-60 |
8-15 |
2-5 |
| 24 часа |
18-20 |
50-90 |
12-20 |
1-3 |
Оценка транспортно-органического (2) этапа йодного обмена состоит в радиоиммунологическом определении уровней тиреоидных гормонов: общего и свободного тироксина (Т4 и СТ4), трийодтиронина (Т3), индекса свободного тироксина (ИСТ4), тироксинсвязывающего глобулина (ТСГ) и тиреотропного гормона гипофиза (ТТ2) в периферической крови пациентов на основе конкуренции между субстратом крови и его меченым аналогом с применением специальных наборов реагентов. Последующее разделение свободной и связанной антисывороткой фракций, с измерением величины активности осадка в колодезном
g-счетчике, позволяет определить уровни концентрации соответствующего гормона. Содержание тиреоидных и тиреотропного гормонов в крови:
-
- тироксин общий 9Т40 у взрослого человека на уровне 100 нмоль/л. При гиперфункции щитовидной железы его количество возрастает до 23/0 нмоль/л, при гипофункции - снижается до 25-30 нмоль/л. Уровень общего тироксина может возрастать при увеличении тироксинсвязывающих сывороточных глобулинов (ТСЧ), в острой фазе гепатитов, тиреоидите; понижается - при нефротическом синдроме, циррозе печени, акромегалии, под влиянием анаболических стероидов, салицилатов, наркотиков, тестостерона;
-
тироксин свободный (СТ4): норма - 10-30 пмоль/л. При гипо- и гипертиреозе содержание СТ4 соответствует уровню общего тироксина;
-
трийодтиронин (Т3): уровень Т3 в крови зависит от возраста, нормальное содержание 1,8±0,04 нмоль/л. У 5-10 % больных тиреотоксикозом уровень Т3 повышен. Вместе с тем при гипотиреозе диагностическая ценность теста невелика, т. к. около 20 % таких больных имеют нормальный уровень Т3. Низкий уровень Т3 наблюдается при функциональной недостаточности печени и почек, злокачественных опухолях, ожоговой болезни, после хирургических операций:
-
тиреотропин (ТТ2): нормальное содержание 2,97±0,03 мкЕ/мл. Секрецию ТТ2 стимулирует пониженная температура или АД, во время беременности и у новорожденных концентрация ТТ2 повышена. Определение уровня ТТ2 имеет наиболее важное значение в оценке функционального состояния системы гипоталамус - гипофиз - щитовидная железа при болезни Иценко-Кушинга, акромегалии, беременности, хронических заболеваниях печени, нефротическом синдроме, где имеют место клинические симптомы гипо- или гиперфункции щитовидной железы. При тиреотоксикозе уровень ТТ2 повышен, при первичной недостаточности гипофиза или гипоталамуса - понижен. - тироксинсвязывающий глобулин (ТС2): норма содержания 20,5±4,8 мг/л. Определение ТС2 обладает диагностической ценностью лишь для тех больных, которые страдают от врожденных аномалий синтеза ТС2 печенью. Обычно необходимость измерения уровня ТС2 связана с определением соотношения Т4/ТС2, с помощью которого осуществляют дифференциальную диагностику тиреоидных состояний. При гипотиреозе этот коэффициент уменьшается почти в 3 раза, при гипертиреозе он возрастает более, чем в 2,5 раза. Оценка периферического (3) этапа йодного обмена осуществляется путем радиометрии всего тела. Пациент принимает 1-2 МБк йодида натрия (131I) и через 2 часа, 3 и 8 дней с помощью многодетекторной установки проводят радиометрию всего тела без экранирования щитовидной железы и с помещением над ней свинцового экрана толщиной 5 см. Различия радиометрических показателей показывают содержание йода в организме, так как к этим срокам (3-й и 8-й день) 131I, не включенный в синтез гормонов, полностью выводится из организма.
Морфологические методы исследования щитовидной железы предназначены для выявления и уточнения характера поражения щитовидной железы, обнаружения атипично расположенной и аберрантной тиреоидной ткани, выбора объема оперативного вмешательства. Показания:
-
наличие узлового поражения щитовидной железы (узловой зоб, злокачественные опухоли, аденомы, кисты)
-
подозрение на врожденную аномалию (загрудинный, лингвальный зоб, добавочная доля);
-
выбор объема операции (при диффузном токсическом зобе, злокачественных опухолях);
-
определение метастазов рака щитовидной железы в другие органы.
Изображение нормальной щитовидной железы включает две доли с перешейком, расположенных по средней линии шеи на 1-2 см выше яремной вырезки рукоятки грудины. При локализации ниже грудинно-ключичного сочленения или выше перстневидного хряща устанавливают загрудинный или лингвальный зоб. По форме наиболее часто напоминает бабочку, реже - подкову. Изображение деформируется после операции или узловых образованиях. У взрослых людей размеры правой доли 5-6х2-2,5 см, размеры перешейка составляют 1/3 длины правой доли. Размеры, накопление РФП и интенсивность изображения левой доли меньше. При диффузной форме зоба, тиреоидите представляются равномерно увеличенные доли и перешеек. Контуры органа четкие, ровные. Контрастность щитовидной железы определяется накоплением активности в ней. Центральная часть каждой доли более контрастная, чем периферическая. Распределение РФП в ткани нормальной щитовидной железы равномерное. При узловом поражении устанавливается точная локализация узла. Если интенсивность изображения узла больше интенсивности окружающей нормальной паренхимы, то очаг определяется как «горячий», а если интенсивность меньше, то как «холодный» узел. При декомпенсированной токсической аденоме визуализируется только «горячий» (гиперфункционирующий) узел. Боковые и срединные кисты шеи представляются «холодными» узлами, расположенными вне ткани щитовидной железы. После оперативного вмешательства по поводу злокачественной опухоли щитовидной железы появление участков, фиксирующих
131I или 99мТс, указывает на рецидив заболевания. Таким же образом можно обнаружить метастазы высокодифференциированного рака щитовидной железы в легкие, кости, мозге и др. органы.
Изотопная гепатография с 131I-бенгалроз является органоспецифическим методом исследования поглотительно-выделительной функции гепатоцитов и проходимости желчных путей и по своей чувствительности превосходит почти все биохимические тесты. Динамическое исследование печени в течение 1-1,5 часов позволяет выявить минимальные отклонения функции гепатоцитов, уточнить тип желтухи, разграничить активно- и неактивно протекающие формы гепатита, определить прогноз заболевания в отдаленные сроки после перенесенного острого гепатита. Для проведения гепатографии может быть использован любой многоканальный радиограф. Датчик, предназначенный для регистрации радиоактивности в печени, устанавливается на 2-3 см выше правой реберной дуги. Второй датчик устанавливается над областью сердца (2-3) межреберье слева для регистрации клиренса крови. Поступление бенгалроз в кишечник определяется третьим датчиком, устанавливаемым слева на уровне пупка. После установки сцинтилляционных датчиков пациенту в/в вводится 0,4-0,8 МБк
131I -бенгалроз. Получаемые данные представляются в виде трех кривых, отображающих динамику содержания бенгалроз в печени (гепатограмма), крови (клиренс крови), тонком кишечнике (еюнограмма).
Гепатограмма содержит 4 сегмента:
-
сегмент начальный подъем кривой, который длится 40-50 сек и отражает сосудистую емкость печени;
-
сегмент - более длительный и пологий подъем (в течение 24-25 мин), отражающий накопление РФП гепатоцитами;
-
сегмент - кривая выравнивает и в течение 20-25 мин. идет в виде плато (наступает равновесие процессов поглощения и выделения нуклида);
-
4 сегмент - кривая постепенно снижается, преобладает выделение РФП
По гепатограмме оцениваются следующие показатели:
-
Т - время наступления максимальной активности в печени (норма 25-30 мин)
-
Тн - время наступления плато (норма 19-20 мин);
-
Тк - время окончания плато (норма 40-45 мин);
-
Тпр - время продолжительности плато (норма 20-25 мин).
Кривая клиренса крови (Скр) отражает скорость очищения крови от введенного РФП (истинная поглотительная функция гепатоцитов) и определяется по периоду полуочищения крови (мин) или в процентах. В норме Скр составляет 48-53%. По гепатограмме, отражающей динамику поступления нуклида в кишечник, определяется время начала подъема кривой выше фонового уровня, свидетельствующего о проходимости желчных путей (норма 30-35 мин) Прием желчегонного завтрака на 20-й минуте позволяет отдифференцировать спазм сфинктера Одди от механического препятствия. При обтурации желчевыводящих протоков РФП и после желчегонного завтрака до конца исследования в кишечник не поступает. Кроме того, в этом случае увеличивается продолжительность Тн, удлиняется Тпр и Тк. Гепатография не является специфичным методом для какого-либо заболевания. При хроническом гепатите, циррозе печени отмечается снижение амплитуды гепатограммы, увеличивается Тн, удлиняется Тк, снижается Скр. Все эти показатели свидетельствуют о различной степени снижения поглотительной функции печени.
Морфологические радионуклидные методы исследования печени используются с целью определения топографо-анатомических особенностей печени, селезенки и выявление наличия портальной гипертензии. Основаны на избирательном накоплении коллоидов в клетках РЭС печени и селезенки с последующим сканированием или статической сцинтиграфией. Коллоидные препараты
198Аu, 99мТс - фитон или 113In - каиноль не участвуют в процессах обмена веществ и поэтому не выводятся из организма, оставаясь в клетках РЭС до полного распада. Исследование проводится в 3-х проекциях: передняя прямая, правая боковая, задняя прямая. Показания: гепатомегалия или спленомегалия, необходимость выявления или исключения первичной опухоли или метастатических поражений печени, подозрение на наличие эхинококковой или другой кисты, абсцесса печени, динамический контроль за состоянием печени после хирургических вмешательств при абсцессах или травмах печени, хронический гепатит, цирроз, тромбофлебит вен селезенки, лимфогранулематоз со спленомегалией для уточнения стадии заболевания, дифференциальная топическая диагностика прилежащей к печени опухоли брюшной полости, релаксация правого купола диафрагмы, аутоиммунная гемолитическая анемия и др. Изображение печени в норме имеет треугольную форму в передней и задней проекции, в боковой округлую. Верхняя граница печени выпуклая, расположена на уровне 5 ребра, нижняя - по краю реберной дуги. Размеры изображения печени на сканограмме точно соответствует размерам органа по Курлову, масштаб измерения на сцинтиграмме 1:2 или 1:5. Латеральный край печени ровный. Нижняя граница печени может быть ровной или менять вырезку на границе правой и левой долей (ложе желчного пузыря). Интенсивность изображения печени (контрастность) характерна: максимальная интенсивность приходится на центр правой доли с постепенным снижением контрастности к периферии; в левой доле интенсивность изображения на 30% меньше, чем в правой. Характер распределения РФП в печени - диффузно-равномерный во всех отделах. В селезенке включения препарата в передней проекции обычно не отмечается (кроме спленомегалии) и лишь в задней проекции может проявляться изображение селезенки. При объемном процессе в печени (опухоль, метастазы, абсцесс, киста) характерными признаками являются: деформация органа, иногда увеличенные размеры и нечеткие контуры, очагово-неравномерный характер распределения нуклида с наличием «холодных» зон, симптом сдвига нормально функционирующей ткани вверх, вниз, в сторону. В массивной правой доле можно определить очаги деструкции печеночной ткани размером не менее 3 см, в левой - свыше 2 см. У больных с хроническим гепатитом, жировой дистрофией печени определяется увеличение органа и снижение контрастности одной из долей, а также нечеткость границ печени, иногда - умеренное повышение включения РФП в селезенке. При циррозе, протекающем с синдромом портальной гипертензии и увеличением селезенки, наблюдается уменьшение размеров и деформация контуров печени с пониженной контрастностью и значительным накоплением нуклеида в селезенке, красном костном мозге (позвоночник, кости таза). В случае тяжелого нарушения кровообращения с выраженными застойными изменениями в печени значительно увеличено изображение всего органа с явным диффузно-неравномерным распределением препарата.
Функционально-морфологическое радионуклидное исследование печени представляет собой динамическую гепатобилисцинтиграфию с использованием современной
g-камеры с ЭВМ и радионуклида 99мТс-ХИДА (ТСК-15) активностью 60-80 МБк. Особенностью препарата является низкая лучевая нагрузка на пациента (0,2 м), не лимитирующая его применение в детской практике. В записанной в память компьютера информации выбирают 4 «зоны интереса»: желчный пузырь, печень, сердце, кишечник. На ЭВМ рассчитывают следующие параметры:
-
клиренс крови (полупериод очищения);
-
время максимального накопления препарата в печени (Тпеч.);
-
время полувыведения препарата из печени (Т1/2, печ.);
- показатель концентрационной функции желчного пузыря;
-
длительность латентного времени до начала опорожнения желчного пузыря (Тлат);
-
показатель двигательной функции желчного пузыря;
-
время начала и интенсивность поступления препарата в кишечник (Ткиш).
Количественный анализ кривых «активность-время», полученных с «зон интереса», и вышеуказанных параметров позволяет комплексно оценить поглотительно-выделительную функцию печени; концентрационную и моторную функцию желчного пузыря; определить наличие рефлюкса желчи в желудок; степень проходимости желчных путей; выявить несостоятельность сфинктеров Одди и Люткенса; уточнить наличие холестаза; охарактеризовать морфологическое состояние печени, желчного пузыря, внутри - и внепеченочных желчевыводящих протоков.
Позволяет оценить такие важные параметры, как легочная вентиляция, состояние внешнего дыхания, бронхиальную проходимость, анатомо-физиологические нарушения в малом круге кровообращения. Перфузионная сцинтиграфия (скеннирование) легких имеет и другое название - пульмоносцинтиграфия. Проводится с целью исследования капиллярного кровообращения легких путем внутривенного введения макро- и микроагрегатов альбумина человеческой сыворотки с величиной частиц более 10 ма, меченых
131I, 113In или 99мТс с активностью 7,4-9,2 МБк, и последующей регистрацией изображения легких с помощью сцинтилляционной
g-камеры или сканнера. Исследование проводят полипозиционно: в передне-задней и задне-передней проекциях. В качестве «зон интереса» при обработке информации выбирают верхний, средний и нижний отделы каждого легкого. В норме интенсивность включения РФП на сцинтиграммах (сканнограммах) равномерно увеличивается в направлении от верхушек легких к их основаниям, а разница в накоплении радионуклида между отделами легких не превышает 5-7%.
Другое название аэрозольной сцинтиграфии легких - бронхосцинтиграфия. Предназначена для определения локализации, характера и распространенности вентиляционных нарушений легких и бронхиальной обструкции. Используются те же РФП, но с введением ингаляционным способом в виде аэрозоля. На аэрозольных сцинтиграммах легких в норме наблюдается равномерное распределение препарата по легочным полям, интенсивность накопления аэрозоля максимальна в центральных и нижних отделах обоих легких. При патологии бронхолегочной системы обнаруживаются участки различной степени гипер- или гипофиксации аэрозоля локального или диффузного характера или неоднородность изображения легочного рисунка вплоть до полного отсутствия фиксации препарата в области патологического процесса.
Радиопульмонография позволяет изучить вентиляционную функцию и капиллярное кровообращение в легких при различной патологии (диффузные и очаговые хронические воспалительные и опухолевые процессы в легких с развитием фиброза, ателектаза и пневмосклероза). Параметры базируются на определении количества
133Хе, поступающего в легкие из спирографа (исследование регионарной вентиляции легких), и путем расчета уровня радиоактивности над легкими при его в/в введении(исследование капиллярного кровотока в легких) активностью 111-148 МБк. Результаты исследований регистрируются в виде кривых и сцинтиграмм раздельно для каждого легкого и его участков. Оценка полученных данных может быть разделена на количественную и качественную (визуальную). При качественной оценке обращают внимание на равномерность распределения активности в легких, локализацию и размеры дефектов («холодных зон») накопления
133Хе. Количественная оценка полученной информации значительно облегчается при выполнении ее на ЭВМ. Определяются следующие показатели функции внешнего дыхания и перфузионной способности для каждого легкого и для каждой его зоны:
-
время смешивания альвеолярного воздуха (в норме - до 3 мин);
-
время полувыведения 133Хе (в норме - до 35 сек);
-
ЖЛ (правое легкое - 53,9±2,6 %, левое - 46,1±2,8%);
-
объем вентилируемого пространства (правое легкое - 51,8±0,8%, левое - 48,2± 0,7%);
-
относительный остаточный объем легких (правое легкое - 35,6±1,3%, левое - 37,7±1,6%);
-
вентиляционно-перфузионное отношение (в норме от 0,8 до 1,0)
Нормальная величина последнего показателя свидетельствует об отсутствии легочной недостаточности. Если вентиляция сохранена, а кровоток изменен, то этот параметр будет превышать 1,0 и, наоборот, при сохранении кровотока, но снижении вентиляции он будет меньше 0,8, а при отсутствии вентиляции равен 0. При центральном раке, сопровождающимся нарушением проходимости бронхов, сосудов и развитием ателектаза, показатели радиопневмограмм характеризуются полным отсутствием вентиляции и регионарного кровотока в зоне поражения (кривые уплощены, деформированы и не поднимаются выше изолинии).
Функциональное радионуклидное исследование почек представляет собой изотопную ренографию, основанную на наружной регистрации
g-излучения над областью почек от введенного
внутривенно 131I - гиппурана (0,3-0,4 МБк), который избирательно захватывается и выводится почками. Показана при наличии мочевого синдрома (гематурия, лейкоцитурия, протеинурия, бактериурия и пр.) болевого синдрома в поясничной области, пастозности или отеков на лице, ногах, травме почек и др. Позволяет дать раздельную оценку для каждой почки скорости и интенсивности секреторной и экскреторной функции, определить проходимость мочевыводящих путей, а по клиренсу крови - наличие или отсутствие почечной недостаточности. Ренограмма здорового человека имеет характерный вид и состоит из трех сегментов:
-
сегмент (сосудистый) - начальный крутой подъем кривой в течение 40-50 сек, который расценивается как следствие поступления
131I - гиппурана в сосудистую систему почки.
-
сегмент (секреторный) - последующий более пологий подъем в течении 3-5 мин, отражающий прохождение РФП через канальцы в полости почки. Заканчивается точкой наивысшего подъема кривой, по которой определяется период максимального накопления препарата (Тmax), после чего преобладает процесс экскреции
131I -гиппурана в мочевой пузырь.
-
сегмент (экскреторный) - крутой спад кривой, связанный с выделением РФП из почки. Время экскреторного сегмента оценивается по периоду полувыведения препарата - Т1/2 (в норме до 12-15 мин).
Типы кривых ренограмм при различных заболеваниях почек:
-
обструктивный (нарушен в основном отток мочи из почки) при мочекаменной болезни, структуре мочеточника, опухоли малого таза, туберкулезе мочеполовой системы и др., когда имеется обструкция мочевыводящих путей;
-
паренхиматозный (замедлена секреторная и выделительная функция почки) при хроническом пиелонефрите,
туберкулезе почек, гидронефрозе и др.;
-
изостенурический (резкое нарушение секреторной и
выделительной функции почки) при нефрите, гипертонической болезни 3 ст.
(первично сморщенная почка):
-
афункциональный при отсутствии секреторно-выделительной функции почки.
Кривая клиренса (очищения) крови от введенного РФП отражает суммарную функцию почек и определяется в процентах. В норме клиренс крови составляет 40-59%, при скрытой почечной недостаточности - от 60 до 72%, при явной почечной недостаточности - выше 73%.
Морфологические методы исследования почек (статическая нефросцинтиграфия или сканирование почек) применяются для определения анатомо-топографических особенностей почек, локализации очага поражения и распространенности патологического процесса в них. Они основаны на избирательном накоплении
99мТс - цитона (200 МБк) нормально функционирующей паренхимой почек. Применяются при подозрении на объемный процесс в почке, обусловленный злокачественной опухолью, кистой, каверной и пр., для выявления врожденной аномалии почек, выбора объема оперативного вмешательства, оценки жизнеспособности пересаженной почки. Нормальные почки имеют бобовидную форму, располагаются на одинаковом расстоянии от срединной линии тела, левая почка несколько ниже правой. Размеры почек 10-12х5-6 см, контуры ровные, четкие. Характер распределения нуклида диффузно-равномерный. Максимальная контрастность изображения приходится на правую почку, левая же всегда менее контрастна ввиду большей отдаленности от детектора. При объемном процессе в почке определяется «холодный» очаг. Отличить доброкачественную опухоль от злокачественной по сканограммам (сцинтиграммам) не всегда возможно, однако неровные контуры «холодного» очага, его неправильная форма более типичны для злокачественной опухоли. Хронический пиелонефрит проявляется диффузно-неравномерным распределением РФП в тканях пораженной почки. При сморщивании почки изображение ее отсутствует или имеются лишь отдельные включения препарата. Легко обнаруживаются врожденные аномалии - подковообразная, удвоенная, дистопированная почка, гипоплазия почки и др.
Функционально-морфологические методы радионуклидного исследования почек сводятся к динамической реносцинтиграфии, которая выполняется на
g-камере с внутривенным быстрым введением 50-75 МБк
99мТс-ДТПА и непрерывной записью кадров в течение 20 минут, отражающих последовательные этапы: сосудистую фазу (1 мин), фазу накопления (1-3 мин) и фазу выведения РФП (4-20 мин). По данным сцинтиграфии оцениваются качественные (морфологические) и количественные признаки. Для количественной оценки результатов исследования выбирают «зоны интереса»: правая и левая почка, сердце и фон, с которых компьютер строит кривые «активность - время». Интерпретацию результатов производят по тем же параметрам и принципам, что и при ренографии. Ангионефросцинтиграфия применяется для выявления сосудистой патологии почек, позволяя не только визуализировать сосудистое ложе почек, но и получить временные линейные параметры прохождения РФП через сосуды почек. Выполняется на сцинтилляционной
g-камере после внутривенного введения 370 МБк 99мТс - ДТПА. Анализ радиоангиосцинтиграмм проводится по двум показателям - времени почечного кровотока (ВПК, норма 10-12 сек).
Сердце - наиболее сложный орган для анализа радиометрическими методами исследования. Оно сокращается с определенной частотой, и это вносит ошибки в получаемое изображение. Сейчас разработан метод оценки состояния сердечной мышцы с использованием препарата
201Tl. Но пока остается не решенной сложная задача оценки всех параметров сердечной деятельности одновременно. Актуальной остается и задача диагностики атеросклероза - до сих пор не известен механизм образования холестериновых бляшек в сосудах.
В медицину активно вошел метод ремоделирования. Он используется при оценке состояния измененного миокарда, например, с рубцом после инфаркта. С помощью ремоделирования можно увидеть динамику функционирования такого измененного сердца, а также прогнозировать эффективность любого терапевтического и хирургического лечения. Изотопная диагностика, в отличие от любого другого метода, позволяет исследовать сердце, непосредственно находящееся под нагрузкой - физической или психологической, и прогнозировать результат такого стрессового воздействия, а значит, в какой-то мере возможное будущее пациента.
Радиокардиография (РКГ) основана на записи в виде кривых, последующем измерении и математическом расчете с помощью ЭВМ показателей циркуляции радиоиндикатора по кровеносной системе. В качестве индикатора используют альбумин человеческой сыворотки, меченный
99мТс либо 131I. Изотопная диагностика предоставляет уникальную возможность в исследовании воспалительных процессов в костной системе и состояния кровоснабжения мозга.
При РКГ определяются следующие гемодинамические показатели и их нормальные значения:
-
объем циркулирующей крови (ОЦК) - 4-6 л;
-
минутный объем сердца (МОС) - 6-8 л/мин
-
ударный объем сердца (УО) - 70-160 мл/уд;
-
сердечный индекс (СИ) - 3,5-5,0 л/м/м2;
-
ударный индекс (УИ) - 40-60 мл/уд. м2
-
время циркуляции крови в легких (Тл) 4-7 сек;
-
объем циркулирующей крови в легких (ОЦКЛ) - 400-700 мл;
-
общее периферическое сопротивление сосудов (ОПС) - 1110-1300 дн. с. см.
Изменение гемодинамических показателей в ту или иную сторону нужно рассматривать только в комплексе всех клинических данных. Например, снижение МОС может наблюдаться при всех состояниях, сопровождающихся снижением ОЦК, таких как острая и хроническая кровопотеря, митральный стеноз и др. Снижение УО наблюдается при тахикардии и понижении МОС. ОПС повышается при артериальной гипертензии и при снижении МОС. Применение метода РКГ у больных с врожденными пороками сердца невозможно, т. к. наличие внутрисердечных шунтов приводит к размыву РФП в полостях сердца, что не позволяет записать кривую РКГ и точно рассчитать количественные показатели гемодинамики. При изучении сброса крови слева - направо и справа - налево в этих случаях можно использовать метод радионуклидной вентрикулографии с использованием
g-камеры.
Цель радионуклидной диагностики инфаркта миокарда: быстро, точно и своевременно установить наличие острого некроза миокарда при инфаркте или травматическом повреждении мышцы сердца в сроки от 24 часов до 7 суток, его локализацию и размеры, оценить степень тяжести, решить вопросы лечебной практики и сделать прогностическую оценку в каждом конкретном случае. Исследование проводится на
g-камере любого типа. Принцип метода основан на избирательном накоплении комплекса
99мТс- пирофосфата (370-550 МБК) в клетках необратимо поврежденного миокарда. Интенсивность включения препарата в миокард оценивается по сопоставлению радиометрических данных в зонах, взятых над сердцем с обеих сторон от грудины. Сцинтиграммы считаются положительными, если уровень радиоактивности в зоне, превышает таковую с противоположной стороны более, чем на 15-20%. Способность РФП накапливаться в очаге острого инфаркта миокарда позволяет констатировать его даже тогда, когда другие методы диагностики неинформативны. Для очага острого инфаркта миокарда типичным следует считать очаговое включение индикатора в зоне повреждения («горячий» очаг). При наличии обширного инфаркта миокарда (по данным ЭКГ, исследованию ферментов и др.) отсутствие включения РФП в миокард является прогностически неблагоприятным признаком.
Основными задачами использования лучевых методов диагностики в онкологии являются: выявление первичного очага злокачественной опухоли, определение распространенности процесса, обнаружение рецидива или метастазов злокачественной опухоли, оценка эффективности применяемой противоопухолевой терапии.
3.6.1 Статическая сцинтиграфия (сканирование) с туморотропным РФП.
Методика основана на том, что РФП накапливаются в клетках опухоли в большем количестве, чем в окружающих здоровых тканях. В настоящее время известен целый ряд так называемых туморотропных радионуклидов, способных накапливаться в различных опухолях. К ним относятся
67Ya -цитрат, 111Zn - блеомицин, 111Zn - цитрин,
75Se - метионин, 99мТс - пирофосфат, вводимые в/в активностью до 110 МБк. Исследование выполняют через 48-72 часа после введения препарата.
В большинстве случаев накопление РФП в опухолевых клетках не является специфичным для определенного типа опухолей. Метод выявления новообразования в этом случае носит название «позитивной» сцинтиграфии (сканирования). При этом опухоль представляется в виде «горячего» очага - зоны высокой радиоактивности. Количественная обработка результатов исследования может осуществляться на ЭВМ; положительным результатом считается наличие очага повышенного накопления РФП, в котором содержание нуклида более 125-130% по сравнению с симметричной здоровой областью.
3.6.2 Метод радиофосфорной диагностики меланомы кожи
В основе метода лежит радионуклидной диагностики меланомы кожи и ее регионарных метастазов лежит особенность фосфорного обмена пролиферирующих тканей, выражающаяся в повышенном включении в них радиоактивного
32Р. Исследование проводится через 48, 50, 52, 54 и 56 часов (двухчасовой интервал выбран с учетом ритмов внутриклеточных процессов) после перорального приема двухзамещенного фосфата натрия, содержащего
32Р активностью 3,7-10,4 Бк/кг. Регистрация b-излучения
32Р производится на специальном b-радиометре. Исследование начинается с определения интенсивности включения РФП в симметричном здоровом участке кожи (контрольная зона), а затем в патологическом образовании. Конечный результат выражается в процентах по отношению к количеству имп/мин над контрольной зоной. «Критерием злокачественности» для меланомы кожи является величина относительного накопления
32Р в патологическом очаге, равная 300±10%.
3.6.3 Диагностика костных заболеваний
Для выявления очагов остеолиза применяют сцинтиграфию костей с дифосфонатами, меченными 99mTc. На рентгенограммах трубчатых костей очаги резорбции видны у одного из эпифизов. Сцинтиграфия костей с меченными 99mTc дифосфонатами позволяет выявить зоны усиленного метаболизма костной ткани. При этом после обострений или на поздних стадиях болезни изотоп не накапливается в очагах резорбции.
В настоящее время в хирургии селезенки доминируют органосохраняющие принципы. Внедрение в клиническую практику широкого спектра хирургических вмешательств, сохраняющих селезенку при заболеваниях и травме требуют применения современных методов диагностики для оценки функционального результата органосохраняющих операций и прогнозирования процессов регенерации селезенки. С этой целью используют широкий спектр лабораторных методов, ультразвуковое исследование, дополненное цветным дуплексным сканированием, рентгеновскую компьютерную томографию и магнитно-резонансную томографию, статическую гамма-сцинтиграфию с радиоактивными коллоидами и мечеными клетками крови. Если лабораторные методы направлены на оценку иммунного статуса, а методы лучевой диагностики позволяют оценивать размеры, структуру оперированной селезенки и уровень кровообращения в ней, то средства ядерной медицины традиционно применяют для изучения ретикулярных структур красной пульпы органа.
Особое место среди методов лучевой диагностики занимает радионуклидное исследование селезенки, основанное на уникальном свойстве этого органа выводить из кровотока грубодисперсный материал и патологически измененные клетки крови. Основным недостатком существующих методов радионуклидного исследования селезенки является отсутствие количественной информации, позволяющей характеризовать функциональное состояние красной пульпы, так как на основании накопления радиопрепарата тканью селезенки судят лишь о сохранности ее функции. Между тем, методы радиоиндикации используются в клинической практике именно для количественной характеристики функционального состояния органов и систем при различных патологических состояниях.
Разработанная недавно динамическая гамма-сцинтиграфия с эритроцитами, меченными
99mTc и поврежденными нагреванием, предоставила возможность оценки временного и количественного параметра эритрофагоцитарной функции красной пульпы селезенки, что позволило изменение в послеоперационный период фильтрационной функции сохраненной при хирургических вмешательствах ткани селезенки.
Остановимся на этом методе несколько подробнее.
В основу сцинтиграфической визуализации селезенки положена ее физиологическая функция – извлечение из кровотока корпускулированных антигенов (механическая фильтрация). В качестве радиопрепаратов (РП), используемых для гамма-сцинтиграфии (ГСГ) селезенки, применяют меченые коллоиды и клетки крови. ГСГ с коллоидными растворами, меченными
198Au, 99mTc, 111In, 113mIn, характеризуется преимущественным распределением радиопрепарата в системе мононуклеарных фагоцитов печени. Лишь 10-20% радиоактивности накапливается тканью селезенки. Селективного изображения селезенки с помощью данной методики получить не удается. Более надежным индикатором для сцинтиграфической детекции ткани селезенки являются эритроциты, меченные
51Cr или 99mTc и поврежденные нагреванием. Радиопрепарат избирательно накапливается ретикулярными структурами красной пульпы, вследствие ее способности к эритрофагоцитозу, что обеспечивает получение селективного сцинтиграфического изображения селезенки. Для сцинтиграфической визуализации селезенки используют также меченные
111In тромбоциты. Существует целый ряд радиопрепаратов, используемых в диагностике злокачественных опухолей и их метастазов, способных накапливаться в селезенке. Например, меченные
111In рецепторы к соматостотину и 67Ga фтордиоксиглюкоза используемая при позитронно-эмиссионной томографии накапливаются в селезенке. Повышенное накопление радиопрепарата - дифференциально-диагностический признак поражения селезенки опухолевым процессом.
Оптимальной методикой радионуклидного исследования селезенки является сцинтиграфия с мечеными эритроцитами, поврежденными нагреванием. В качестве радиоактивной метки используются изотопы
51Cr и 99mTc. Применение 51Cr для маркировки эритроцитов ограничивается высокой лучевой нагрузкой на обследуемого, несмотря на достоинство методики – довольно высокий выход меченых форменных элементов, достигающий 60-90%. При использовании
99mTc лучевая нагрузка меньше, но выход меченых эритроцитов значительно ниже – не превышает 22%.
Для повышения связывания 99mTc с эритроцитами в процессе маркировки используются ионы олова. В присутствии хлорида или фторида олова анионы пертехнетата
99mTc восстанавливают свою валентность с +7 до +4, что повышает их способность связываться со структурами молекул гемоглобина эритроцитов. Эта методика простота исполнения и дает максимальный выход меченых красных кровяных телец.
Изображение, характеризующее распределение радиопрепарата в организме, можно получить в статическом или динамическом режиме исследования. Если статическая ГСГ позволяет определить лишь анатомо-топографические характеристики, наличие участков с измененной функцией, а также характер поражения органа, то при динамической гамма-сцинтиграфии (ДГС) дополнительно проводится количественная оценка функциональной активности. В зависимости от параметров сбора информации можно оценивать фазу биомеханического транспорта радиопрепарата (по просвету сосудов) и фазу метаболического транспорта (через клеточные мембраны). Таким образом, становится возможной динамическая оценка физиологических процессов и выявление степени их нарушения.
Компьютерная обработка и анализ данных ДГС предусматривает несколько этапов: визуальную оценку сцинтиграфических изображений; выделение зон интереса, соответствующих исследуемым органам; построение кривых «активность-время», демонстрирующих перераспределение радиопрепарата в указанных зонах; математическую обработку кривых с расчетом показателей, характеризующих функциональное состояние исследуемого органа.
Информация, получаемая при ДГС, представляется в виде серии снимков – кадров. На начальном этапе визуально оценивают перераспределение радиоактивности в проекции исследуемых органов. Далее выделяют зоны интереса, что позволяет количественно учесть число зарегистрированных импульсов радионуклида на каждом кадре и использовать эти данные для построения динамической кривой накопления и/или выведения радиопрепарата органом. Конечный результат компьютерной обработки данных ДГС предусматривает анализ кривой «активность-время» с определением временных (время максимального накопления – Tmax, период полувыведения радиопрепарата – T1/2 и др.) и количественных параметров распределения радиопрепарата, СПИ – селезеночно-печеночный индекс. Данные ДГС позволяют проводить количественную оценку функционального состояния исследуемых органов и тканей.
Маркировку эритроцитов проводят по следующей методике: через 30 минут после внутривенного введения пирофосфата, содержащего 0,5 мг хлорида или флюорида олова, проводили забор 6 мл венозной крови с добавлением 50 Ед гепарина. Кровь инкубировали с 2000
mCi (74 MBk) пертехнетата 99mTc в течение 15 минут при температуре 37оС. Затем меченые эритроциты подвергали нагреванию на водяной бане при температуре 49-50оС в течение 35 минут.
Динамическую гамма-сцинтиграфию проводят, например, на гамма-камерах «DIACAM» и «MULTISPECT-II» (Siemens, Германия) с компьютерной системой обработки данных ICON. Регистрацию сцинтиграмм проводят в динамическом режиме (всего 450 кадров, 1 кадр – 20с). Исследование проводят в задней проекции, устанавливая детектор гамма-камеры максимально близко к поверхности спины человека, таким образом, чтобы в поле зрения детектора находились селезенка и печень. Свежеприготовленный радиопрепарат реинъецировали пациенту в локтевую вену в момент включения регистрирующей системы. Продолжительность исследования - 150 минут.
Диагностическая ценность метода полностью определяется качеством приготовления радиопрепарата, поскольку присутствие свободного изотопа (в наших наблюдениях – пертехнетата
99mTc) не связанного с эритрацитами сильно затрудняет интерпретацию результатов исследования или делает ее вовсе невозможной. Поэтому следует добиваться радиопрепарата с высоким выходом меченых клеток.
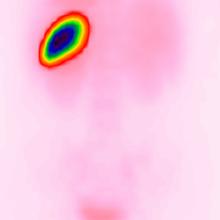 Рис. 1. Динамическая гамма-сцинтиграфия с эритроцитами, меченными
99mTc и поврежденными нагреванием. Сцинтиграмма пациентки Т., 47 лет, 14-е сутки после тампонирования разрыва селезенки по поводу травмы. Задняя проекция. Получено селективное изображение селезенки, радиоактивность окружающих тканей – минимальная.
Рис. 1. Динамическая гамма-сцинтиграфия с эритроцитами, меченными
99mTc и поврежденными нагреванием. Сцинтиграмма пациентки Т., 47 лет, 14-е сутки после тампонирования разрыва селезенки по поводу травмы. Задняя проекция. Получено селективное изображение селезенки, радиоактивность окружающих тканей – минимальная.
Изображение селезенки удается получить только в том случае, когда радиоактивность накопленного тканью селезенки радиопрепарата превышает уровень фона окружающих тканей (рис.1).
Математическая обработка кривых «активность-время» сводится к расчету показателей, характеризующих функциональное состояние красной пульпы селезенки: а) Tmax – время максимального накопления радиопрепарата селезенкой. Характеризуется интервалом времени от начала исследования до момента достижения максимальной радиоактивности в проекции селезенки. б) СПИ – селезеночно-печеночный индекс -максимальная радиоактивность, накопленная в селезенке, выраженная в процентах от суммарной радиоактивности селезенки и печени.
Значение временного параметра в точке выхода кривой «активность-время» на плато, Tmax, характеризует процессы доставки меченых эритроцитов в ткань селезенки и утилизации поврежденных клеток, которые разрушаются во время транзита из красной пульпы в синусоиды. Следовательно, механизмы деструкции денатурированного клеточного материала, должны находиться в зависимости от уровня кровоснабжения селезенки и состояния иммунной системы. Tmax - показатель, характеризующий кровоснабжение (перфузию) ткани селезенки и/или гиперактивацию механизмов фагоцитоза в красной пульпе при аутоиммунных процессах.
Селезеночно-печеночный индекс – параметр, отражающий максимальное накопление радиопрепарата в селезенке по отношению к этому показателю, полученному с печени – количественно характеризует участие красной пульпы селезенки в процессах эритрофагоцитоза. Снижение или увеличение СПИ определяется уменьшением массы и размеров селезенки после хирургического вмешательства или изменениями при патологических состояниях.
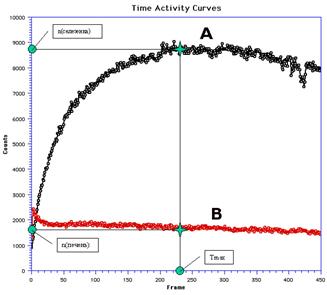 Рис. 2. Принцип расчета показателей, характеризующих функциональное состояние красной пульпы селезенки: А - кривая «активность-время», отражающая процесс изменения радиоактивности в проекции селезенки; В - кривая «активность-время», отражающая процесс изменения радиоактивности в проекции печени;
n(селезенка) - суммарный счет радиоактивности, зафиксированный с области селезенки;
n(печень) - суммарный счет радиоактивности, зафиксированный с области печени; Tmax - время максимального накопления радиопрепарата селезенкой.
Рис. 2. Принцип расчета показателей, характеризующих функциональное состояние красной пульпы селезенки: А - кривая «активность-время», отражающая процесс изменения радиоактивности в проекции селезенки; В - кривая «активность-время», отражающая процесс изменения радиоактивности в проекции печени;
n(селезенка) - суммарный счет радиоактивности, зафиксированный с области селезенки;
n(печень) - суммарный счет радиоактивности, зафиксированный с области печени; Tmax - время максимального накопления радиопрепарата селезенкой.
Нормальные величины Tmax и СПИ составляют 100-105 минут и 87-90% соответственно. Критерием эффективности органосохраняющей операции на селезенке является изменение СПИ; чем менее выражено снижение СПИ, тем выше эффективность вмешательства. Показатель Tmax следует учитывать лишь при несоответствии объема сохраненной ткани селезенки кровообращению в ней.
Принцип расчета Tmax и СПИ представлен на Рис.2.
Рассмотрим радионуклидную семиотику послеоперационных изменений в селезенке в зависимости от количества сохраненной ткани и условий ее кровообращения.
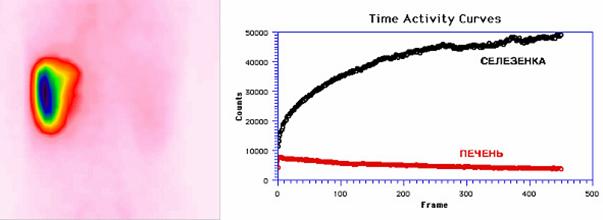 Когда орган был сохранен полностью, визуализировали обычно расположенную селезенку с ровными четкими контурами, достаточным накоплением радиопрепарата и равномерным его распределением в ткани органа (Рис.3).
Когда орган был сохранен полностью, визуализировали обычно расположенную селезенку с ровными четкими контурами, достаточным накоплением радиопрепарата и равномерным его распределением в ткани органа (Рис.3).
Рис. 3. Сцинтиграмма и кривые «активность-время» с областей селезенки и печени
При атипичной резекции в проекции левого поддиафрагмального пространства визуализировали культю селезенки, значительно уменьшенную в размерах. Даже после максимального накопления меченых эритроцитов ее тканью, радиоактивность препарата, циркулирующего в крови, была достаточно высока и на сцинтиграммах наряду с культей селезенки визуализировали печень, сердце, крупные сосуды (рис. 4).
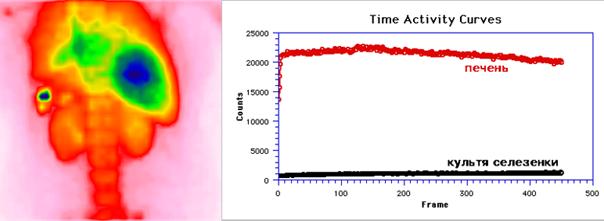 Рис. 4. Сцинтиграмма и кривые «активность-время» с областей культи селезенки и печени пациентки Ж., 40 лет, 28-е сутки после атипичной резекции селезенки по поводу травмы. Задняя проекция. СПИ=4,2%; Tmax=105 минут.
Рис. 4. Сцинтиграмма и кривые «активность-время» с областей культи селезенки и печени пациентки Ж., 40 лет, 28-е сутки после атипичной резекции селезенки по поводу травмы. Задняя проекция. СПИ=4,2%; Tmax=105 минут.
При обследовании пациентов с экстраперитонеальной аутоспленотранспланта-цией в сроки до 5 недель раннего послеоперационного периода накопления меченых эритроцитов аутотрансплантатом не наблюдалось (Рис. 5).
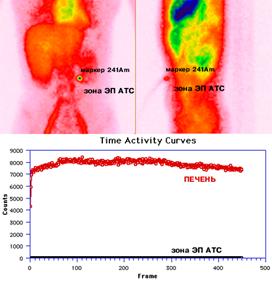 Рис. 5. Сцинтиграммы и кривые «активность-время» с областей ЭП АТС и печени пациентки Н., 27 лет, 14-е сутки после спленэктомии с ЭП АТС по поводу травмы. Передняя и левая боковая проекции. Накопления радиопрепарата в зоне ЭП АТС не отмечается. Для определения точной локализации зоны ЭП АТС использован маркер
241Am.
Рис. 5. Сцинтиграммы и кривые «активность-время» с областей ЭП АТС и печени пациентки Н., 27 лет, 14-е сутки после спленэктомии с ЭП АТС по поводу травмы. Передняя и левая боковая проекции. Накопления радиопрепарата в зоне ЭП АТС не отмечается. Для определения точной локализации зоны ЭП АТС использован маркер
241Am.
Начиная с пятой недели, регистрировали инициальное накопление меченых эритроцитов в зоне аутотрансплантации при высоком содержании радиопрепарата в проекции печени, сердца, крупных сосудов (Рис. 6).
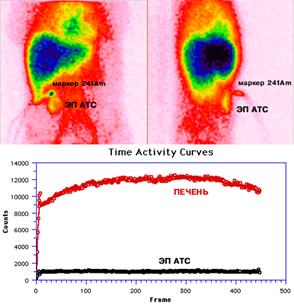 Рис. 6. Сцинтиграммы и кривые «активность-время» с областей ЭП АТС и печени пациентки Ш., 35 лет, 40-е сутки после спленэктомии с ЭП АТС по поводу травмы. Передняя и правая боковая проекции. СПИ=5,4%; Tmax>150 минут. Для определения точной локализации зоны ЭП АТС использован маркер
241Am.
Рис. 6. Сцинтиграммы и кривые «активность-время» с областей ЭП АТС и печени пациентки Ш., 35 лет, 40-е сутки после спленэктомии с ЭП АТС по поводу травмы. Передняя и правая боковая проекции. СПИ=5,4%; Tmax>150 минут. Для определения точной локализации зоны ЭП АТС использован маркер
241Am.
При расчете показателей функционального состояния красной пульпы было установлено, что Tmax и СПИ статистически значимо отличаются от нормы и составляют соответственно 150 минут и 6,3%.
После любого резекционного вмешательства на селезенке происходит снижение СПИ и увеличение Tmax, особенно выраженное в раннем послеоперационном периоде после удаления основной массы ткани и/или редукции селезеночного кровообращения. В отдаленном периоде происходит частичное, но не полное восстановление временных и количественных параметров, регистрируемых с помощью ДГС.
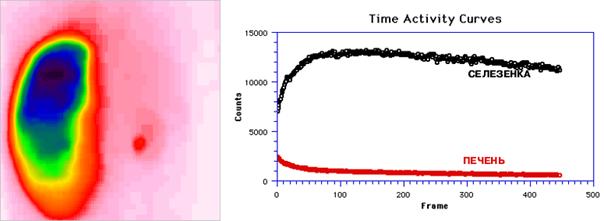 При хронических миело- и лимфопролиферативных процессах визуализировали гигантскую селезенку, занимающую большую часть брюшной полости (рис. 7). Отмечали достаточное накопление радиопрепарата и равномерное распределение его в ткани органа. Показатель Tmax существенно снижался и составлял 20 минут, а СПИ повышался до 91,4%.
При хронических миело- и лимфопролиферативных процессах визуализировали гигантскую селезенку, занимающую большую часть брюшной полости (рис. 7). Отмечали достаточное накопление радиопрепарата и равномерное распределение его в ткани органа. Показатель Tmax существенно снижался и составлял 20 минут, а СПИ повышался до 91,4%.
Рис. 7. Сцинтиграмма и кривые «активность-время» с областей селезенки и печени пациентки Е., 17 лет, с хроническим вирусным гепатитом В. Задняя проекция. СПИ=90,5%; Tmax=25 минут.
У пациентов с инфарктом селезенки на сцинтиграммах отчетливо виден дефект накопления радиопрепарата, имеющий правильную геометрическую форму (Рис.8). При расчете показателей функционального состояния красной пульпы СПИ снижался и составлял 71,7%, а Tmax повышалось до 120 минут.
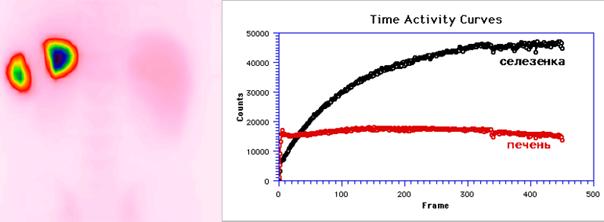 Рис.
8. Сцинтиграмма и кривые «активность-время» с областей селезенки и печени пациента Л., 50 лет, на 7-е сутки после возникновения инфаркта селезенки. Задняя проекция. В проекции средней доли отмечается дефект накопления радиопрепарата правильной геометрической формы, соответствующий инфарцированным сегментам селезенки. Визуальный анализ сцинтиграфического изображения позволяет косвенно определить уровень нарушения кровоснабжения в органе – артерии II порядка. СПИ=71,1%; Tmax=120 минут.
Рис.
8. Сцинтиграмма и кривые «активность-время» с областей селезенки и печени пациента Л., 50 лет, на 7-е сутки после возникновения инфаркта селезенки. Задняя проекция. В проекции средней доли отмечается дефект накопления радиопрепарата правильной геометрической формы, соответствующий инфарцированным сегментам селезенки. Визуальный анализ сцинтиграфического изображения позволяет косвенно определить уровень нарушения кровоснабжения в органе – артерии II порядка. СПИ=71,1%; Tmax=120 минут.
Таким образом, динамическая гамма-сцинтиграфия селезенки с эритроцитами, меченными
99mTc и поврежденными нагреванием, позволяет охарактеризовать фильтрационную функцию красной пульпы селезенки путем количественной оценки одного из ее механизмов – эритрофагоцитоза. Критериями количественной оценки являются время максимального накопления меченых эритроцитов в селезенке (Tmax) и соответствующий ему количественный параметр, рассчитанный по отношению к радиоактивности печени – селезеночно-печеночный индекс (СПИ). После органосохра-няющих вмешательств на селезенке ее фильтрационная функция снижается, что выражается в снижении СПИ. В отдаленном послеоперационном периоде этот показатель возрастает до субнормальных или нормальных значений в зависимости от количества сохраненной ткани селезенки и условий кровообращения в ней. Регенерация в очагах спленоза сопровождается частичным восстановлением фильтрационной функции красной пульпы селезенки пропорционально срокам послеоперационного периода. При гематологической патологии, сопровождающейся спленомегалией и аутоиммунными гемолитическими процессами, фильтрационная функция селезенки активируется, что выражается значительным сокращением Tmax и увеличением СПИ. Очаговые поражения селезенки сопровождаются снижением фильтрационной функции красной пульпы лишь при выраженном нарушении кровообращения в органе (инфаркт селезенки), что проявляется при ДГС повышением Tmax и уменьшением СПИ по сравнению с нормальными величинами.
Можно выделить следующие сферы применения динамической гамма-сцинтиграфии при оценке функционального состояния красной пульпы селезенки:
-
Оценка эффективности органосохраняющих операций на селезенке. Количественная оценка функциональной активности оперированной селезенки в комплексе с другими методами позволяет сравнивать результаты органосохраняющих вмешательств в различных вариантах и выбирать наиболее рациональную технику из альтернативных. Очевидно, операцию, сопровождающуюся минимальными нарушениями фильтрационной функции селезенки, следует признать оптимальной.
-
Выявление послеоперационного спленоза и количественная характеристика регенерации в очагах эктопированной ткани селезенки. ДГС выступает не только в качестве чувствительного метода диагностики, но и позволяет прогнозировать компенсацию гипоспленических расстройств или, наоборот, возврат гематологической симптоматики после патогенетически обоснованной спленэктомии.
-
Дифференциальная диагностика аутоиммунных процессов, сопровождающихся разрушением эритроцитов, и пролиферативных заболеваний, поражающих селезенку, с другими гематологическими расстройствами. Снижение Tmax – признак аутоиммунного лизиса, компрометирующего красный кровяной росток. ДГС позволяет оценивать эффективность медикаментозной коррекции гемолитического процесса и формулировать показания к спленэктомии при резистентном течении процесса.
-
Количественная оценка гипоспленических расстройств при очаговых поражениях селезенки. Определение исходных параметров фильтрационной функции красной пульпы селезенки имеет значение при выборе лечебной тактики, а также создает предпосылки для динамической оценки эффективности проводимого лечения.
Рентгенография – основной инструментальны метод диагностики метаболических болезней костей. Она хорошо выявляет деминерализацию костной ткани и псевдопереломы. При этом такие патологии, как остеопения (аномально низкая масса костной ткани) на обычных рентгенограммах определяется только при потере 30—50% костной массы. Компьютерная рентгеновская диагностика в этом смысле намного информативнее.
В 70-х годах для оценки массы костей и содержания минеральных веществ в основном веществе кости был разработан метод изотопной абсорбциометрии. В этом методе исследуемый участок скелета помещают между источником гамма-частиц (131I,
153Gd) и детектором излучения, соединенным с компьютером. Часть гамма-частиц поглощается при прохождении через кость. По величине поглощения рассчитывают плотность костной ткани и содержание в ней минеральных веществ. Основной недостаток изотопной абсорбциометрии - значительная лучевая нагрузка (50 -500 Зв).
В последнее время для диагностики остеопении и остепороза чаще всего проводят денсиметрию методом двухфотонной рентгеновской абсорбциометрии. Принцип метода тот же, но вместо излучателей гамма-частиц используется рентгеновская трубка, дающая гораздо меньшую лучевую нагрузку (< 10 Зв). Двухфотонная рентгеновская абсорбциометрия — высокочувствительный метод. Он позволяет выявить потерю всего 2—3% массы кости. В США и некоторых европейских странах двухфотонную рентгеновскую абсорбциометрию используют для массовых обследований женщин в постменопаузе для ранней диагностики остеопороза.
Часто денситометрию костей сочетают с нейтронно-активационным анализом содержания кальция в организме. Иногда для исследования костей используют, эмиссионную томографию, осуществляя сцинтиграфию костей с дифосфонатами, меченными
99mTc.
 Рис. 1. Динамическая гамма-сцинтиграфия с эритроцитами, меченными
99mTc и поврежденными нагреванием. Сцинтиграмма пациентки Т., 47 лет, 14-е сутки после тампонирования разрыва селезенки по поводу травмы. Задняя проекция. Получено селективное изображение селезенки, радиоактивность окружающих тканей – минимальная.
Рис. 1. Динамическая гамма-сцинтиграфия с эритроцитами, меченными
99mTc и поврежденными нагреванием. Сцинтиграмма пациентки Т., 47 лет, 14-е сутки после тампонирования разрыва селезенки по поводу травмы. Задняя проекция. Получено селективное изображение селезенки, радиоактивность окружающих тканей – минимальная. Рис. 2. Принцип расчета показателей, характеризующих функциональное состояние красной пульпы селезенки: А - кривая «активность-время», отражающая процесс изменения радиоактивности в проекции селезенки; В - кривая «активность-время», отражающая процесс изменения радиоактивности в проекции печени;
n(селезенка) - суммарный счет радиоактивности, зафиксированный с области селезенки;
n(печень) - суммарный счет радиоактивности, зафиксированный с области печени; Tmax - время максимального накопления радиопрепарата селезенкой.
Рис. 2. Принцип расчета показателей, характеризующих функциональное состояние красной пульпы селезенки: А - кривая «активность-время», отражающая процесс изменения радиоактивности в проекции селезенки; В - кривая «активность-время», отражающая процесс изменения радиоактивности в проекции печени;
n(селезенка) - суммарный счет радиоактивности, зафиксированный с области селезенки;
n(печень) - суммарный счет радиоактивности, зафиксированный с области печени; Tmax - время максимального накопления радиопрепарата селезенкой. Когда орган был сохранен полностью, визуализировали обычно расположенную селезенку с ровными четкими контурами, достаточным накоплением радиопрепарата и равномерным его распределением в ткани органа (Рис.3).
Когда орган был сохранен полностью, визуализировали обычно расположенную селезенку с ровными четкими контурами, достаточным накоплением радиопрепарата и равномерным его распределением в ткани органа (Рис.3). Рис. 4. Сцинтиграмма и кривые «активность-время» с областей культи селезенки и печени пациентки Ж., 40 лет, 28-е сутки после атипичной резекции селезенки по поводу травмы. Задняя проекция. СПИ=4,2%; Tmax=105 минут.
Рис. 4. Сцинтиграмма и кривые «активность-время» с областей культи селезенки и печени пациентки Ж., 40 лет, 28-е сутки после атипичной резекции селезенки по поводу травмы. Задняя проекция. СПИ=4,2%; Tmax=105 минут. Рис. 5. Сцинтиграммы и кривые «активность-время» с областей ЭП АТС и печени пациентки Н., 27 лет, 14-е сутки после спленэктомии с ЭП АТС по поводу травмы. Передняя и левая боковая проекции. Накопления радиопрепарата в зоне ЭП АТС не отмечается. Для определения точной локализации зоны ЭП АТС использован маркер
241Am.
Рис. 5. Сцинтиграммы и кривые «активность-время» с областей ЭП АТС и печени пациентки Н., 27 лет, 14-е сутки после спленэктомии с ЭП АТС по поводу травмы. Передняя и левая боковая проекции. Накопления радиопрепарата в зоне ЭП АТС не отмечается. Для определения точной локализации зоны ЭП АТС использован маркер
241Am. Рис. 6. Сцинтиграммы и кривые «активность-время» с областей ЭП АТС и печени пациентки Ш., 35 лет, 40-е сутки после спленэктомии с ЭП АТС по поводу травмы. Передняя и правая боковая проекции. СПИ=5,4%; Tmax>150 минут. Для определения точной локализации зоны ЭП АТС использован маркер
241Am.
Рис. 6. Сцинтиграммы и кривые «активность-время» с областей ЭП АТС и печени пациентки Ш., 35 лет, 40-е сутки после спленэктомии с ЭП АТС по поводу травмы. Передняя и правая боковая проекции. СПИ=5,4%; Tmax>150 минут. Для определения точной локализации зоны ЭП АТС использован маркер
241Am. При хронических миело- и лимфопролиферативных процессах визуализировали гигантскую селезенку, занимающую большую часть брюшной полости (рис. 7). Отмечали достаточное накопление радиопрепарата и равномерное распределение его в ткани органа. Показатель Tmax существенно снижался и составлял 20 минут, а СПИ повышался до 91,4%.
При хронических миело- и лимфопролиферативных процессах визуализировали гигантскую селезенку, занимающую большую часть брюшной полости (рис. 7). Отмечали достаточное накопление радиопрепарата и равномерное распределение его в ткани органа. Показатель Tmax существенно снижался и составлял 20 минут, а СПИ повышался до 91,4%. Рис.
8. Сцинтиграмма и кривые «активность-время» с областей селезенки и печени пациента Л., 50 лет, на 7-е сутки после возникновения инфаркта селезенки. Задняя проекция. В проекции средней доли отмечается дефект накопления радиопрепарата правильной геометрической формы, соответствующий инфарцированным сегментам селезенки. Визуальный анализ сцинтиграфического изображения позволяет косвенно определить уровень нарушения кровоснабжения в органе – артерии II порядка. СПИ=71,1%; Tmax=120 минут.
Рис.
8. Сцинтиграмма и кривые «активность-время» с областей селезенки и печени пациента Л., 50 лет, на 7-е сутки после возникновения инфаркта селезенки. Задняя проекция. В проекции средней доли отмечается дефект накопления радиопрепарата правильной геометрической формы, соответствующий инфарцированным сегментам селезенки. Визуальный анализ сцинтиграфического изображения позволяет косвенно определить уровень нарушения кровоснабжения в органе – артерии II порядка. СПИ=71,1%; Tmax=120 минут.